§ 14. Свойства химических связей
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 14. Свойства химических связей |
| Напечатано:: | Гость |
| Дата: | Sunday, 2 November 2025, 14:07 |
Свойства веществ определяются не только их элементным составом, но и особенностями химических связей между атомами.
Свойства ковалентной связи

длины связи по
расстоянию между
ядрами химически
связанных атомов
Ковалентная связь характеризуется длиной, энергией, кратностью, насыщаемостью, направленностью и полярностью.
Длина ковалентной связи — это расстояние между ядрами химически связанных атомов (рис. 27). Длина ковалентной связи обычно немного отличается от суммы атомных радиусов из-за перераспределения электронной плотности и перекрывания электронных облаков (рис. 27–29). Чем больше радиусы связанных атомов, тем больше длина связи (табл. 12).
Таблица 12. Характеристика ковалентных связей в молекулах водорода и галогеноводородов
| Элемент | Радиус атома, нм | Молекула | Длина связи, нм | Eсвязи, кДж/моль | Δχ | Модель молекулы |
| Н | 0,037 | H2 | 0,074 | 436 | 0 | |
| F | 0,071 | HF | 0,092 | 565 | 1,8 | |
| Cl | 0,099 | HCl | 0,128 | 431 | 0,8 | |
| Br | 0,114 | HBr | 0,141 | 364 | 0,6 | |
| I | 0,133 | HI | 0,161 | 297 | 298 |
Энергия химической связи (Eсвязи) — это энергия, которую необходимо затратить на её разрыв. Как правило, чем прочнее связь, тем меньше её длина (табл. 12).
Кратностью ковалентной связи называют число электронных пар, которые участвуют в образовании химической связи между двумя атомами.

Различают одинарные (), двойные (
) и тройные (
) связи. При перекрывании орбиталей вдоль линии, соединяющей ядра атомов, образуются только σ-связи (рис. 28).
Но две или три ковалентные связи между двумя атомами не могут одновременно образовываться в одной плоскости. Поэтому в случае двойных и тройных связей происходит «боковое» перекрывание р- или d-орбиталей, то есть образуются π-связи:
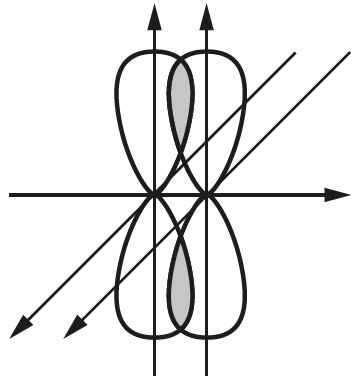
Например, двойная связь в молекуле кислорода ![]() образуется при перекрывании двух р-орбиталей. При этом перпендикулярно расположенные р-орбитали образуют одну σ- и одну π-связи (рис. 29).
образуется при перекрывании двух р-орбиталей. При этом перпендикулярно расположенные р-орбитали образуют одну σ- и одну π-связи (рис. 29).

при образовании σ-связи и π-связи в молекуле O2
Тройная связь в молекуле азота ![]() возникает при перекрывании трёх р-орбиталей. При этом образуется одна σ-связь и две π-связи, как показано на рисунке 30.
возникает при перекрывании трёх р-орбиталей. При этом образуется одна σ-связь и две π-связи, как показано на рисунке 30.

облаков при образовании σ- и π-связей в молекуле N2
Кратность связи наглядно указывают в структурных формулах. Так, в молекуле формальдегида две одинарные и одна двойная связь: ![]() . При этом в ней три σ-связи и одна π-связь.
. При этом в ней три σ-связи и одна π-связь.
Направленность ковалентных связей определяется ориентацией в пространстве атомных орбиталей, участвующих в образовании связи. Она обусловливает пространственную структуру молекул (рис. 31).

Угол, образованный направлениями химических связей, исходящими из одного атома, называют валентным углом.
Например, вам известно, что в молекуле CH4 связи расположены под углом приблизительно 109°, в молекуле — 120°, в молекуле
— 180°.

перекрывания электронных облаков в молекуле H2S
В молекулах Н2О и Н2S атомы кислорода и серы образуют две σ-связи с атомами водорода. В образовании этих связей участвуют p-орбитали внешнего энергетического уровня, которые ориентированы взаимно перпендикулярно. Это значит, что валентные углы между линиями связи О—Н или S—H должны быть близки к 90°. Однако реальные значения этих углов немного больше из-за взаимного отталкивания атомов водорода (рис. 32). Так, в молекуле воды, находящейся в парах, этот угол равен 104,5°, а в молекуле Н2S — 92° (отталкивание слабее из-за большего радиуса атома серы).
Аналогично: в молекулах NH3 три взаимно перпендикулярные р-орбитали атома азота образуют три σ-связи с атомами водорода и валентные углы должны быть равными 90°. Взаимное отталкивание атомов водорода приводит к увеличению этих углов до 107°. Подробнее этот материал рассмотрен в § 37.
Для прогнозирования и объяснения величины валентных углов во многих молекулах часто используют представления о гибридизации атомных орбиталей. Начальные представления о гибридизации вы получили в курсе органической химии в 10-м классе. С учётом гибридизации можно объяснить строение молекул СН4, NH3, H2O. При гибридизации атомных орбиталей атома, образующего связи с соседними атомами, происходит усреднение по форме и энергии электронной плотности близких по энергии орбиталей. Например, при усреднении энергии одной s-орбитали и трёх р-орбиталей данного атома углерода образуются четыре одинаковые гибридные орбитали, которые располагаются по направлению к вершинам тетраэдра:
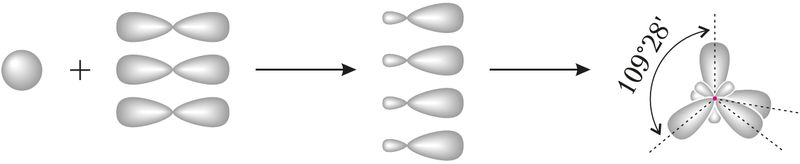
Тетраэдрическое строение молекулы метана объясняется sp3-гибридизацией атомных орбиталей углерода.
Полярность связи — характеристика, учитывающая смещение общей электронной пары к одному из атомов. Если ковалентная связь образована атомами с одинаковой электроотрицательностью, связь относят к неполярной (H2, Cl2, N2). В случае разной электроотрицательности связь будет полярная (НСl, NH3). Чем больше разность значений электроотрицательности (Δχ) у связанных атомов, тем больше полярность ковалентной связи. Например, связь в молекуле H—Cl более полярна, чем в молекуле H—Br, поскольку электроотрицательность атома Сl (3,0) больше, чем у Br (2,8). На атомах возникает частичный (нецелочисленный) заряд. Его обозначают символами δ+, δ–.
Смещение электронной плотности указывают в структурных формулах стрелками, направленными в сторону более электроотрицательного атома. Смещение электронной плотности при образовании σ-связи указывают прямой стрелкой, а π-связи — дугой:
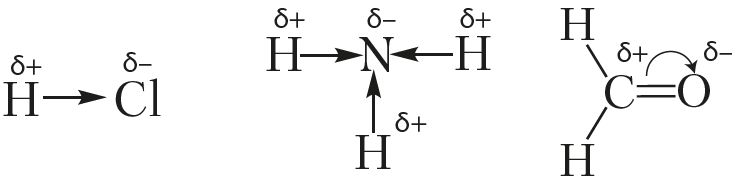
Молекулу, электронное строение которой описывается как система из двух равных по абсолютной величине, но противоположных по знаку зарядов, расположенных на определённом расстоянии друг от друга, называют диполем.
Молекулы, представляющие собой диполи, называют полярными. Полярными являются молекулы галогеноводородов, сероводорода, воды. Так, в молекуле воды электронная плотность от атомов водорода смещена к более электроотрицательному атому кислорода. Молекулы воды — это диполи (рис. 33).

Насыщаемостью называют способность атома образовывать определённое число ковалентных связей. Это число связей определяется валентностью атома. Любой атом ограничен в своих возможностях образовывать ковалентные связи. Их не может быть больше числа атомных орбиталей, которые могут принять участие в образовании ковалентных связей. Для элементов 2-го периода таких связей не может быть больше четырёх, так как на внешнем электронном слое атомов этих элементов имеется только четыре орбитали. У элементов 3-го периода насыщаемость повышается за счёт вакантных d-орбиталей.
Свойства ионной и металлической связей
Длина и энергия ионных связей зависят от размера и заряда взаимодействующих ионов. Как правило, чем меньше размер и больше заряд ионов, тем прочнее связь. Значения её энергии находятся в пределах 300–700 кДж/моль.
В отличие от ковалентной связи ионная связь ненаправленная и ненасыщаемая, поскольку ион может притягивать к себе ионы противоположного знака в любом направлении. Расположение и число соседних ионов определяется их размерами, силами притяжения и отталкивания между ионами разных знаков. Поэтому ионы располагаются в определённом порядке, образуя кристаллическую решётку.
Металлическая связь также ненаправленная и ненасыщаемая. Её энергия изменяется в широких пределах: от десятков до нескольких сотен кДж/моль. В кристаллах металлов атомы имеют большое число ближайших соседей, что обеспечивает очень плотную упаковку атомов. Так, в кристаллах у атома меди 12 ближайших соседей, а у иона натрия в NaCl — шесть соседних ионов Cl–. Строение кристаллов можно представить в виде плотно упакованных шаров (рис. 34).

Ковалентная связь характеризуется длиной, энергией, кратностью, направленностью и полярностью:
- • длина — расстояние между ядрами химически связанных атомов;
- • энергия связи — энергия, которую необходимо затратить на её разрыв;
- • кратность — число электронных пар, участвующих в образовании связи;
- • направленность ковалентных связей определяется ориентацией в пространстве атомных орбиталей, участвующих в образовании связи;
- • полярность связи определяется степенью смещения общей электронной пары к одному из атомов;
- • насыщаемость — способность атома образовывать определённое число ковалентных σ-связей.
Ионная и металлическая связи ненаправленные и ненасыщаемые.
Вопросы, задания, задачи
1. Опишите, как образуется:
- а) тройная связь в молекуле азота;
- б) двойная связь в молекуле кислорода.
2. Заполните таблицу, поставив в ячейки под каждой химической связью подходящее значение энергии (167; 945; 418 кДж/моль) и длины связи (0,145; 0,110; 0,125 нм). Объясните свой выбор.
| Связь | |||
| Энергия, кДж/моль | |||
| Длина, нм |
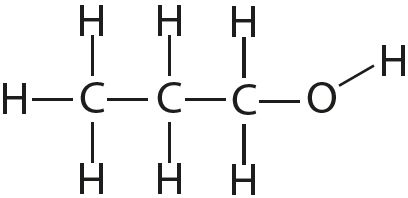
3. Укажите число одинарных и кратных связей в каждой молекуле:
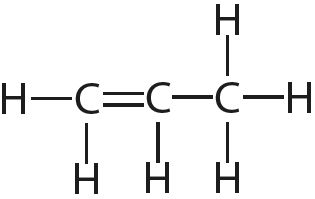
4. Отметьте полярные и неполярные ковалентные связи:
5. Объясните, почему и как меняется длина связи между атомами в ряду:
- а) углерода:
,
,
;
- б) азота:
,
.
6. Сопоставьте длину и энергию связи между атомами углерода и кислорода в ряду: метанол , метаналь
, угарный газ
![]() .
.
7. Объясните уменьшение термической устойчивости соединений в ряду: Н2О, Н2S, Н2Se.
8. Объясните, почему молекулы водорода и фтора вступают во взаимодействие мгновенно, а для взаимодействия молекул водорода и азота нужны высокие температура и давление.
9. Нарисуйте схему перекрывания атомных 1s- и 3p-орбиталей в молекуле H2X, если относительная плотность этого газообразного соединения по водороду равна 17.
10. Энергия связи в молекуле O2 равна 494 кДж/моль. Какую энергию нужно затратить, чтобы разорвать все связи в образце кислорода объёмом 1 дм3 (н. у.)?
*Самоконтроль
1. Направленностью и насыщаемостью характеризуется связь:
- а) ковалентная неполярная;
- б) ионная;
- в) металлическая;
- г) ковалентная полярная.
2. Две связывающие и две несвязывающие электронные пары содержат молекулы:
3. σ-Связи соответствует перекрывание орбиталей:
4. Длина связи в первой молекуле больше, чем во второй, в паре веществ:
- а) HCl и HBr;
- б) H2S и H2O;
- в) NH3 и PH3;
- г) NCl3 и PCl3.
5. Энергия связи уменьшается в рядах:
- а) HCl, HBr, HI;
- б)
,
,
;
- в) I2, Br2, Cl2;
- г) N2, O2, I2.