§ 37. Аммиак
Водородное соединение азота аммиак — вещество молекулярного строения. Его структурная формула ![]() . В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
. В молекуле аммиака, как указано в § 13, имеются три одинарные ковалентные полярные связи, образованные по обменному механизму. Электронная плотность смещена к атому азота, у которого имеется неподелённая пара s-электронов. Поэтому молекула аммиака полярна и имеет конфигурацию тригональной пирамиды (рис. 89).
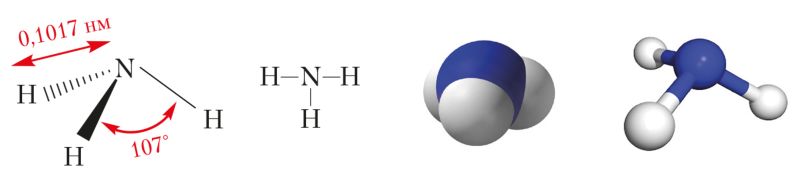
Взаимное отталкивание атомов водорода приводит к увеличению валентного угла между направлениями ковалентных связей N—H от 90° до 107°.
Строение молекулы аммиака. Форма пирамиды в молекуле аммиака и валентный угол 107° при её вершине объясняются образованием связей между гибридными орбиталями атома азота и s-орбиталями атома водорода.
Согласно концепции гибридизации, в образовании ковалентных связей участвуют не исходные валентные три 2p-орбитали внешнего электронного уровня атома азота, а три из четырёх sp3-гибридных орбиталей, схема образования которых показана на рисунке 89.1(а–г).
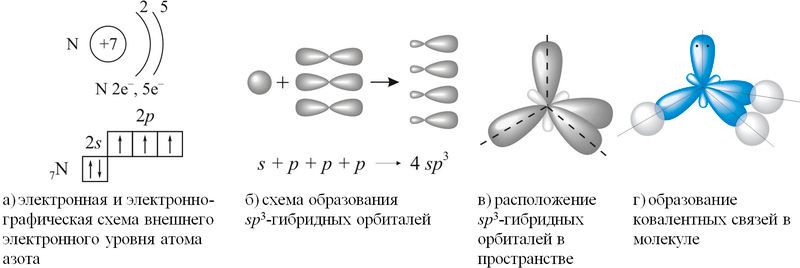
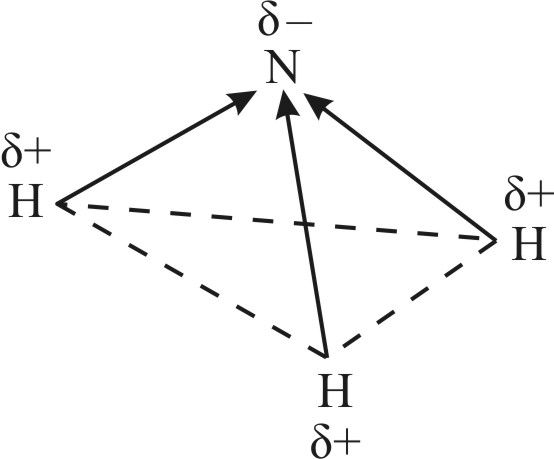
Неподелённая электронная пара четвёртой гибридной орбитали обладает незначительной отталкивающей силой, что объясняет уменьшение валентного угла H—N—H со 109,5° до 107. Расположение трёх ковалентных полярных связей под углом приводит к асимметричному распределению электронной плотности, то есть к полярности молекулы:
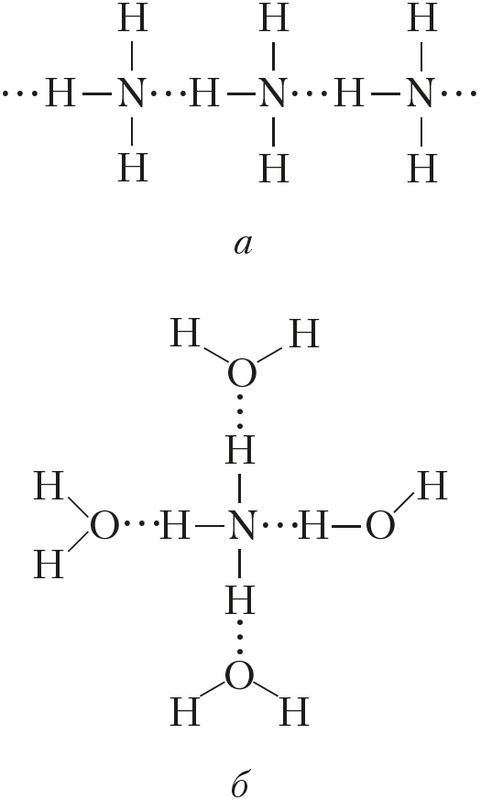
Физические свойства. Аммиак — бесцветный газ (н. у.) с характерным резким запахом (запах нашатырного спирта). Он хорошо растворяется в воде: при 20 °С в одном объёме воды растворяется около 700 объёмов аммиака (сравним: О2 — 0,03, SO2 — 40, НСl — 400 объёмов). Температура кипения аммиака довольно высокая и составляет –33 °С. При небольшом давлении этот газ легко сжижается. Температура плавления — –78 °С, ниже её аммиак существует в виде бесцветных кристаллов. Высокая температура кипения и растворимость в воде обусловлены наличием значительного межмолекулярного взаимодействия, то есть образованием водородных связей как между самими молекулами аммиака (в твёрдом и жидком состояниях), так и между молекулами воды и аммиака (в водном растворе) (рис. 90).
Получение аммиака. Аммиак является одним из ключевых продуктов химической промышленности. Его мировое производство растёт вместе с глобальным спросом на удобрения и в настоящее время превышает 220 млн тонн в год. В Республике Беларусь его производит ОАО «Гродно Азот» — более 1 млн тонн в год.
В промышленности аммиак синтезируют из азота и водорода. Реакция экзотермическая и обратимая, катализатором служит железо, оптимальная температура синтеза — 420–450°С, давление — 30–100 МПа:
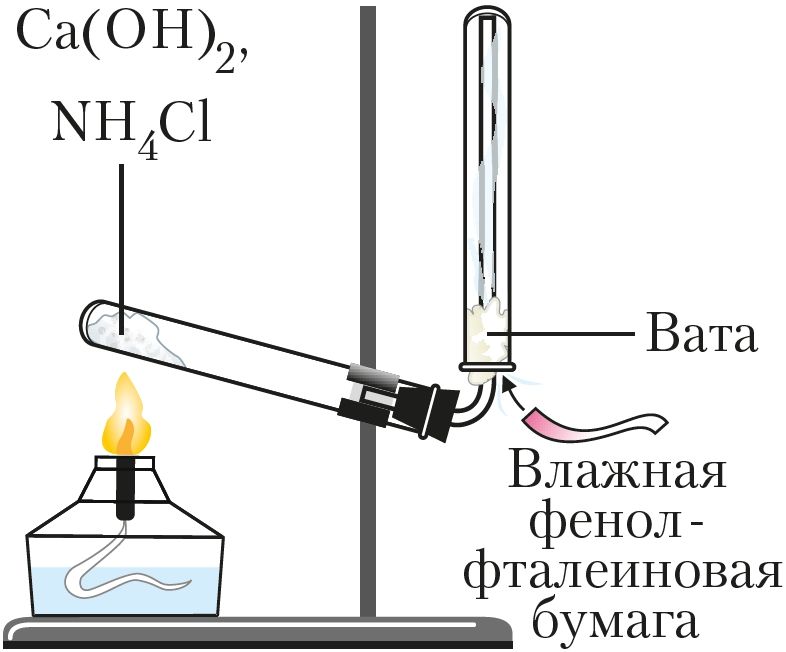
Для получения аммиака в лаборатории нагревают смесь двух твёрдых веществ — хлорида аммония NH4Cl и гидроксида кальция Са(ОН)2 (рис. 91):
Химические свойства. Для аммиака характерны реакции, протекающие как без изменения степени окисления азота, так и окислительно-восстановительные. В первом случае основную роль играет неподелённая электронная пара атома азота. За счёт её образуются новые ковалентные связи по донорно-акцепторному механизму. С другой стороны, наличие атома азота в низшей степени окисления ‒3 обусловливает реакции только с повышением степени окисления. Это означает, что аммиак проявляет свойства восстановителя.
I. Реакции без изменения степени окисления протекают, если аммиак взаимодействует с водой и кислотами. При этом аммиак проявляет основные свойства.
Растворение аммиака в воде приводит к образованию гидрата аммиака NH3 · H2O — слабого основания (рис. 92).
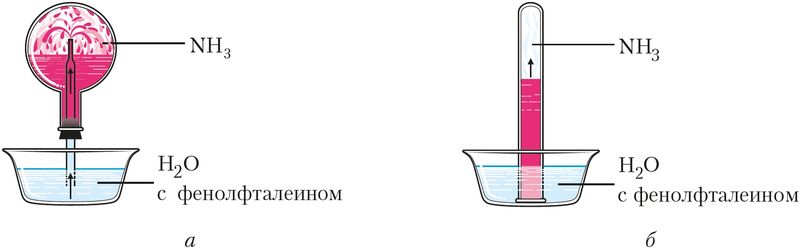
Водные растворы аммиака имеют щелочную среду (рН > 7) и окрашиваются фенолфталеином в малиновый цвет.
Взаимодействие аммиака с кислотами:
II. Реакции с изменением степени окисления атома азота. Это реакции аммиака как восстановителя. Восстановительные свойства аммиак проявляет в реакциях с кислородом. Состав продуктов зависит от условий проведения реакции. В чистом кислороде и на воздухе он сгорает при нагревании (в смесях — взрывается) с образованием азота и воды, а в присутствии катализаторов (платины, оксидов железа(III) и хрома(III)) образуются оксид азота(II) и вода:
Реакция каталитического окисления аммиака важна как этап его переработки в азотную кислоту.