§ 13. Природа и типы химической связи
Вопросы, задания, задачи
1. Определите тип химической связи, представленный электронными схемами:
| а) | в) | ||
| б) | г) |
2. Составьте электронные формулы молекул водорода, хлора, хлороводорода, воды, аммиака и укажите число связывающих и неподелённых электронных пар в каждой из них.
3. Укажите тип химической связи между атомами в следующих соединениях:
- а) СaCl2, BaO, S8, CaF2, CCl4, сплав Fe—C;
- б) I2, SiO2, Na2S, О3, C2H5OH, сплав Au—Cu.
4. Сравните электронные схемы и электронные конфигурации:
- а) атома Li и иона Li+ в бромиде лития;
- б) атома Сl и иона Сl– в хлориде калия;
- в) атома S и атома серы в молекуле сероводорода.
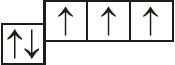
5. Назовите механизм образования связи между атомами, имеющими следующие электронно-графические схемы внешних электронных оболочек:
- а)
и
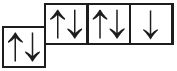
- б)
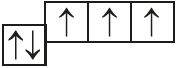 и
и 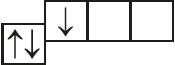
- в)
и
6. Согласно приведённой схеме объясните механизм образования ковалентной связи в ионе гидроксония при взаимодействии молекулы воды и иона водорода:
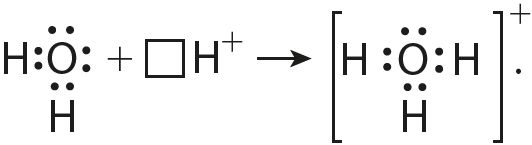
7. Используя значения электроотрицательности элементов (табл. 7), дайте обоснование типу химической связи в веществах и частицах: ,
,
,
,
,
.
| Химическая формула вещества или частицы | Электроотрицательность атомов | Разность электроотрицательностей ∆χ |
Тип химической связи | |
| χ1 | χ2 | |||
8. Укажите соединения, имеющие как ковалентную, так и ионную связь: НСООН, CH3COONa, MgF2, MgSO4, NH4NO3, HNO3, KNO3, CaSO4, NH3.
9. Рассчитайте число электронов, участвующих в образовании ковалентных связей в ионах аммония количеством 3 моль.
10. При образовании метана из атомов углерода и водорода выделяется 1662 кДж/моль энергии. Вычислите среднюю энергию связи С—Н (кДж/моль).