§ 13. Природа и типы химической связи
Ковалентная связь
Ковалентная связь — это химическая связь, образованная общими (связывающими) электронными парами. Её называют локализованной, так как общая пара электронов размещается (локализуется) между двумя ядрами. Это заставляет положительно заряженные ядра притягиваться к паре электронов, расположенной между ядрами. Такая связь возникает между атомами с одинаковыми или близкими значениями электроотрицательности. Как правило, это атомы неметаллов.
Появление пары электронов, связывающей соседние атомы, можно представить двумя способами, то есть существует два механизма образования ковалентной связи — обменный и донорно-акцепторный.
Обменный механизм объясняет образование общей электронной пары из неспаренных валентных электронов, принадлежащих разным атомам. При этом электроны, образующие общую пару, должны иметь противоположные (антипараллельные) спины. Перекрывание двух электронных облаков приводит к увеличению электронной плотности между ядрами:
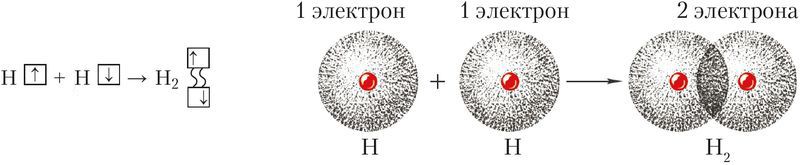
В образовании ковалентной связи могут участвовать s-, p- и d-электронные облака. Например, в связывании атомов хлора и водорода в молекуле H—Сl участвуют 1s-электрон атома водорода и неспаренный 3p-электрон атома хлора (рис. 24).
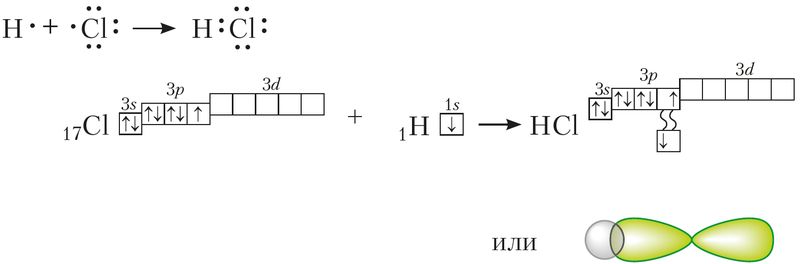
Каждый из связанных в общую электронную пару атомов приобретает электронную конфигурацию благородного газа: водород — гелия 1s2, а хлор — аргона 1s22s22р63s23р6. В результате оба атома достигают наиболее устойчивой электронной конфигурации.
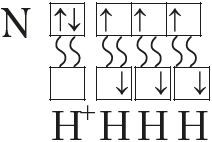
Ещё один пример — образование связей в молекуле аммиака NH3. У атома азота согласно электронно-графической схеме есть три неспаренных электрона: 7N 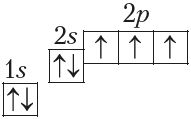 , у атома водорода — один
, у атома водорода — один . Эти электроны участвуют в образовании трёх ковалентных связей по обменному механизму с атомами водорода:
![]() или
или ![]()
Отметим, что одновременно с этим у азота на 2s-орбитали остаётся неподелённая электронная пара — пара электронов, не принимающая участия в образовании химических связей.
Обменным механизмом объясняют образование ковалентной связи в подавляющем большинстве молекул органических и неорганических веществ, в атомных кристаллах алмаза C, красного фосфора P, карборунда SiC, кварца SiO2 и др.
Донорно-акцепторный механизм образования ковалентной связи предполагает образование общей пары электронов за счёт передачи неподелённой электронной пары от одного атома (донора) на вакантную атомную орбиталь другого (акцептора). В качестве примера рассмотрим образование химической связи в катионе аммония при протекании реакции:
(хлорид аммония)
или в ионном виде:
(ион аммония).
Это взаимодействие можно представить электронными формулами:
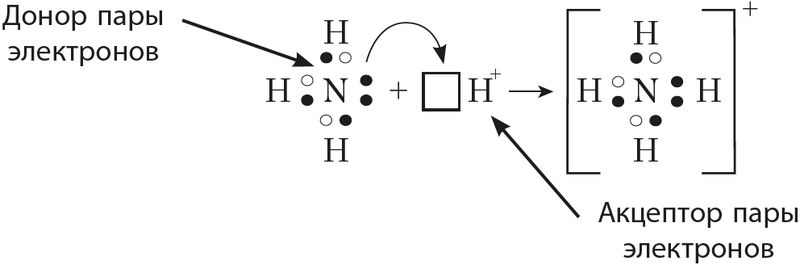
При взаимодействии молекулы 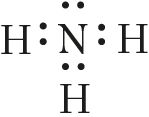 с катионом водорода
с катионом водорода , у которого на 1s-орбитали нет электронов, неподелённая пара электронов азота размещается на свободной 1s-орбитали
иона водорода. В результате образуется катион аммония
с четырьмя ковалентными связями:
Так как молекула аммиака электронейтральна, а присоединённый к ней ион имеет заряд «+», то образовавшийся катион аммония также имеет положительный заряд. Этот заряд принадлежит целому иону, а не отдельному атому, поэтому в структурной формуле знак заряда иона ставят за квадратной скобкой: 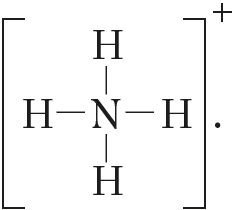 Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору:
Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору: 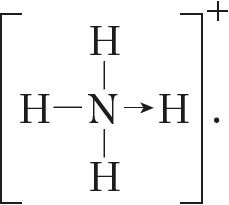 Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными.
Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными.
Аналогичным образом можно представить образование химической связи в катионе гидроксония H3O+: в результате гидратации иона водорода в водных растворах неподелённая электронная пара атома кислорода в молекуле воды размещается на свободной 1s-орбитали иона водорода.
Донорно-акцепторным механизмом объясняют образование ковалентной связи в молекулах угарного газа ![]() , азотной кислоты
, азотной кислоты 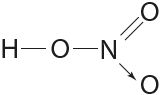 и др.
и др.