§ 11. Периодичность изменения свойств атомов химических элементов и образуемых ими веществ
Периодичность изменения электроотрицательности атомов
В 1932 году Л. Полинг ввёл в химию понятие электроотрицательности как меры способности данного атома притягивать к себе электроны от химически связанных с ним других атомов.
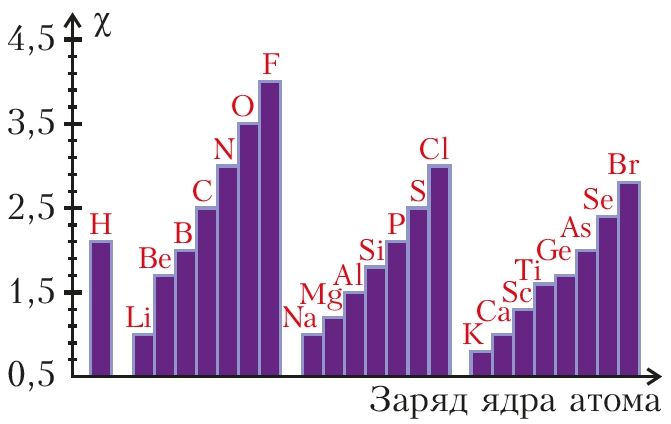
атомов с ростом заряда их ядер
Значения электроотрицательности (χ) приводятся в справочниках (рис. 22, табл. 7). Существует несколько шкал и способов определения электроотрицательности. Мы будем использовать шкалу Полинга.
Анализ данных рисунка 22 указывает на периодический характер изменения электроотрицательности с ростом атомного номера элемента: по периоду она увеличивается, по группе — уменьшается. Объяснить это можно тем, что в периоде по мере роста заряда ядра электроны сильнее притягиваются к ядру, в группе с ростом числа электронных слоёв притяжение ослабевает.
К элементам с наибольшей электроотрицательностью относятся F, O, N, Cl. Самым электроотрицательным элементом является фтор (χ = 4,0). Самая низкая электроотрицательность у щелочных металлов.