§ 11. Периодичность изменения свойств атомов химических элементов и образуемых ими веществ
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Падручнік: | § 11. Периодичность изменения свойств атомов химических элементов и образуемых ими веществ |
| Надрукаваны: | Гость |
| Дата: | Субота 12 Ліпень 2025 |
Змест
- Периодичность изменения свойств атомов химических элементов и образуемых ими веществ
- Периодичность изменения радиусов атомов элементов
- Периодичность изменения электроотрицательности атомов
- Периодичность изменения степеней окисления
- Периодичность в изменении свойств простых и сложных веществ
- *Зависимость свойств оксидов и гидроксидов от значения степени окисления элемента в соединении
- Выводы
- Вопросы, задания, задачи
- *Самоконтроль
Объяснить и предсказать химические свойства веществ (металлические и неметаллические, окислительно-восстановительные и кислотно-основные) можно, используя сведения о периодическом изменении свойств атомов по мере увеличения заряда их ядра, важнейшие из которых — радиус атома, значения его электроотрицательности и степени окисления. Проанализируем, как эти свойства зависят от электронного строения атомов.
Периодичность изменения радиусов атомов элементов
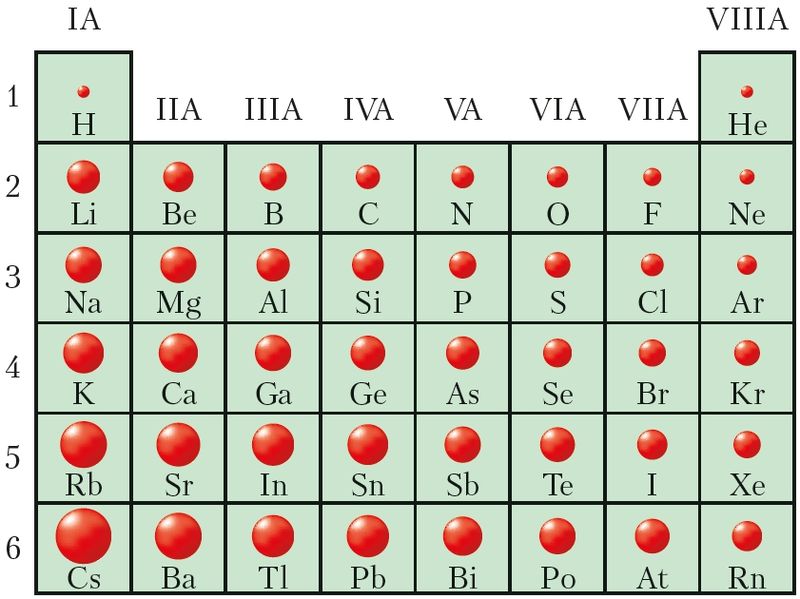
Радиус атома определяется размером его электронной оболочки. С точки зрения вероятности нахождения электрона в околоядерном пространстве атом не имеет чётких границ. Поэтому радиус атома — это условная величина. За радиус атома будем принимать расстояние от ядра до внешней электронной оболочки, занятой электронами. Как указано в § 9, в сфере с таким радиусом сосредоточено около 90 % электронной плотности.
Сопоставив характер изменения радиусов атомов (рис. 21) с их электронным строением, можно сделать следующие выводы:
- • в периоде радиусы атомов уменьшаются, так как с ростом заря а ядра электроны сильнее притягиваются к ядру;
- • в группе радиусы атомов увеличиваются из-за роста числа электронных слоёв;
- • изменение значений радиусов атомов с ростом заряда ядра носит периодический характер. В пределах каждого периода наибольшим радиусом обладают атомы щелочных металлов, а наименьшим — атомы благородных газов.
Значения радиусов атомов являются важной характеристикой химических элементов, поскольку они определяют связь внешних, валентных, электронов с атомом. Чем меньше радиус, тем сильнее валентные электроны удерживаются в атоме и наоборот.
Силы притяжения или отталкивания заряженных частиц определяются законом Кулона: сила взаимодействия двух заряженных тел прямо пропорциональна произведению модулей их зарядов и обратно пропорциональна квадрату расстояния между ними:
Периодичность изменения электроотрицательности атомов
В 1932 году Л. Полинг ввёл в химию понятие электроотрицательности как меры способности данного атома притягивать к себе электроны от химически связанных с ним других атомов.
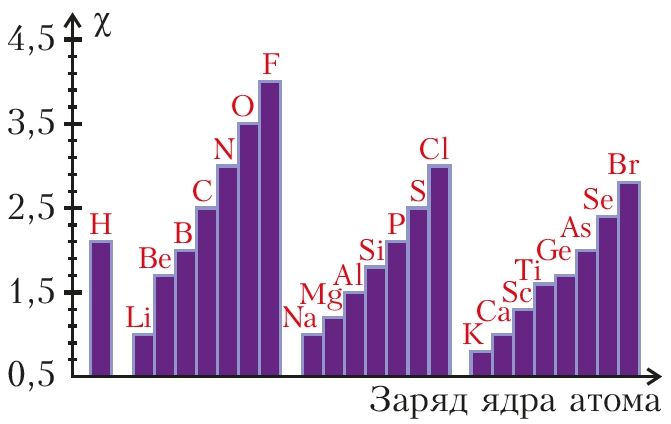
атомов с ростом заряда их ядер
Значения электроотрицательности (χ) приводятся в справочниках (рис. 22, табл. 7). Существует несколько шкал и способов определения электроотрицательности. Мы будем использовать шкалу Полинга.
Анализ данных рисунка 22 указывает на периодический характер изменения электроотрицательности с ростом атомного номера элемента: по периоду она увеличивается, по группе — уменьшается. Объяснить это можно тем, что в периоде по мере роста заряда ядра электроны сильнее притягиваются к ядру, в группе с ростом числа электронных слоёв притяжение ослабевает.
К элементам с наибольшей электроотрицательностью относятся F, O, N, Cl. Самым электроотрицательным элементом является фтор (χ = 4,0). Самая низкая электроотрицательность у щелочных металлов.
Периодичность изменения степеней окисления
Напомним, что степень окисления — это условный заряд атома в химическом соединении, вычисленный из предположения, что это соединение состоит из ионов. При определении степени окисления считают, что электроны, участвующие в химической связи, полностью переходят к более электроотрицательному атому. Число присоединённых атомом электронов показывает значение отрицательной степени окисления, число отданных — значение положительной степени окисления.
Анализ высших и низших степеней окисления, значения которых приведены в таблице 7, позволяет сделать следующие выводы:
- • у атомов металлов наблюдаются только положительные степени окисления, у неметаллов — как отрицательные, так и положительные;
- • высшая положительная степень окисления атома равна максимальному числу электронов на внешней электронной оболочке атома, поэтому она по каждому периоду возрастает;
- • низшая отрицательная степень окисления атомов неметаллов определяется числом электронов, которые атом может принять до заполнения внешней электронной оболочки, поэтому она отрицательна и в периоде убывает по абсолютной величине от 4 (элементы IVA-группы) до 1 (элементы VIIA-группы);
- • атомы в химических соединениях могут быть в промежуточных степенях окисления; чем больше на внешнем электронном слое электронов, тем больше у атома возможных степеней окисления и, следовательно, больше вариантов возможных химических соединений.
Таблица 7. Наиболее характерные степени окисления и электроотрицательность атомов элементов 1–3-го периодов
| Группа | IA | IIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Элементы | H | He | Li | Be | B | C | N | O | F | Ne | Na | Mg | Al | Si | P | S | Cl | Ar | |
| Электроотрицательность | 2,2 | 1,0 | 1,6 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 | 0,9 | 1,3 | 1,6 | 1,9 | 2,2 | 2,6 | 3,0 | ||||
| Степени окисления | +7 | +7 | |||||||||||||||||
| +6 | +6 | ||||||||||||||||||
| +5 | +5 | +5 | +5 | ||||||||||||||||
| +4 | +4 | +4 | +4 | +4 | |||||||||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | ||||||||||||||
| +2 | +2 | +2 | +2 | +2 | +2 | ||||||||||||||
| +1 | +1 | +1 | +1 | +1 | +1 | ||||||||||||||
| 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | |
| –1 | –1 | –1 | –1 | -1 | |||||||||||||||
| –2 | –2 | –2 | -2 | ||||||||||||||||
| –3 | –3 | –3 | |||||||||||||||||
| –4 | –4 | –4 | |||||||||||||||||
| Формула электронной конфигурации внешнего электронного слоя | 1s1 | 1s2 | 2s1 | 2s2 | 2s22p1 | 2s22p2 | 2s22p3 | 2s22p4 | 2s22p5 | 2s22p6 | 3s1 | 3s2 | 3s23p1 | 3s23p2 | 3s23p3 | 3s23p4 | 3s23p5 | 3s23p6 | |
Периодичность в изменении свойств простых и сложных веществ
При делении химических элементов на металлы и неметаллы используют критерии, связанные со свойствами образуемых ими простых и сложных веществ (табл. 8).
Таблица 8. Отличительные признаки металлов и неметаллов
| Строение и свойства | Металлы | Неметаллы |
| Строение и свойства атомов | При взаимодействии с неметаллами отдают им свои электроны | При взаимодействии с металлами притягивают к себе их электроны |
| На внешнем электронном слое содержится, как правило, 1–3 электрона | На внешнем электронном слое содержится 4–8 электронов, кроме атомов В, He и H | |
| Имеют низкие значения электроотрицательности | Имеют высокие значения электроотрицательности | |
| Физические свойства простых веществ | Высокая электро- и теплопроводность простых веществ. Электропроводность снижается с ростом температуры | Теплоизоляционные свойства простых веществ высокие. Низкая электропроводность |
| Пластичность простых веществ | Хрупкость простых веществ | |
| Общие свойства соединений | В водных растворах солей преимущественно существуют в виде катионов | В водных растворах солей существуют в составе анионов |
| Образуют преимущественно основные и амфотерные оксиды | Образуют кислотные оксиды | |
| Образуют сильные и слабые основания | Образуют сильные и слабые кислоты |
Проявление металлических свойств простыми веществами связано со способностью атомов, имеющих низкие значения электроотрицательности, терять электроны. В периодах с уменьшением размеров атомов электроотрицательность растёт, ослабевают металлические и восстановительные свойства простых веществ. Периоды начинаются щелочными металлами, а заканчиваются неметаллами — благородными газами. В группах с увеличением радиуса атома электроотрицательность уменьшается, усиливаются металлические и восстановительные свойства простых веществ, соответственно, неметаллические и окислительные — ослабевают.
Ослабление металлических свойств по периоду выражается ещё и в том, что у оксидов и гидроксидов элементов основные свойства постепенно ослабевают и переходят в амфотерные, а далее нарастают кислотные свойства (табл. 9). Атомы с наиболее высокими значениями электроотрицательности образуют кислоты.
Таблица 9. Кислотно-основные свойства оксидов и гидроксидов элементов третьего периода
| Параметры сравнения | Группа | ||||||
| I | II | III | IV | V | VI | VII | |
| Высшая степень окисления | +1 | +2 | +3 | +4 | +5 | +6 | +7 |
| Высший оксид и его свойства | Na2O | MgO | Al2O3 | SiO2 | P2O5 | SO3 | Cl2O7 |
| Основные оксиды | Амфотерный оксид | Кислотные оксиды | |||||
| Гидроксид и его свойства | NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
| Основания | Амфотерный гидроксид | Очень слабая кислота | Слабая кислота | Сильная кислота | Очень сильная кислота | ||
| Водородные соединения (гидриды) | NaH | MgH2 | AlH3 | SiH4 | PH3 | H2S | HCl |
| Нелетучие водородные соединения металлов | Летучие водородные соединения неметаллов | ||||||
При одинаковом значении степеней окисления атомов основные свойства гидроксидов (и оксидов) возрастают с увеличением размера атомов и уменьшением их электроотрицательности, так как ослабевает взаимодействие катионов металлов с гидроксид-ионами. Поэтому сила оснований возрастает по группам периодической системы.
В группах с увеличением радиусов атомов элементов кислотные свойства оксидов и гидроксидов постепенно ослабевают (табл. 10).
Следует отметить, что водородные соединения металлов — твёрдые вещества, а неметаллов — как правило, газообразные вещества.
Таблица 10. Кислотно-основные свойства оксидов и гидроксидов некоторых элементов IIA-группы
| Период | Группа IIA | ||
| Элемент | Высший оксид и его свойства | Гидроксид и его свойства | |
| 2 | Be | ВеО — амфотерный оксид | Be(OH)2 — амфотерный гидроксид |
| 3 | Mg | MgO — основный оксид | Mg(OH)2 — основание |
| 4 | Ca | CaO — основный оксид | Ca(OH)2 — сильное основание |
| 5 | Sr | SrO — основный оксид | Sr(OH)2 — сильное основание |
*Зависимость свойств оксидов и гидроксидов от значения степени окисления элемента в соединении
Степень окисления атомов, образующих оксиды и гидроксиды, влияет на характер свойств этих веществ.
Например, в ряду оксидов по мере увеличения степени окисления атомов элемента происходит ослабление основных и нарастание кислотных свойств. Так, у Li2O выражены основные свойства, у BeO — уже амфотерные, у остальных оксидов — кислотные, причём сила кислотных свойств нарастает с увеличением степени окисления в ряду
.
Аналогичная закономерность наблюдается и для соответствующих этим оксидам гидроксидов: LiOH — сильное основание; Be(OH)2 — амфотерный гидроксид; Н3ВО3 (или B(OH)3) и H2CO3 — слабые кислоты; HNO3 — сильная кислота.
| Оксиды | |||||
| Гидроксиды | |||||
| Растёт степень окисления, уменьшается радиус атома элемента | |||||
| Нарастают кислотные свойства | |||||
| Ослабевают основные свойства | |||||
Усиление кислотных свойств оксидов и гидроксидов с увеличением значения степени окисления элемента в соединении наблюдается и для отдельных элементов. Так, изменение свойств в ряду кислородсодержащих кислот хлора можно выразить следующей схемой:
| Растёт степень окисления атома хлора | |||
| Усиливаются кислотные свойства, повышается устойчивость соединений | |||
| Усиливается окислительная способность | |||
Таким образом, c увеличением значения степени окисления хлора устойчивость его гидроксидов (кислот) растёт, а их окислительная способность уменьшается. Наиболее сильным окислителем является хлорноватистая кислота (HClO), а наименее сильным — хлорная кислота (HClO4).
Такая же закономерность — усиление кислотных свойств гидроксида (и, соответственно, ослабление его основных свойств) — с ростом степени окисления элемента характерна не только для хлора, но и для других элементов. Наиболее ярко эта закономерность прослеживается в оксидах и гидроксидах хрома и марганца, что мы специально рассмотрим в § 49.1.
- С увеличением заряда атомных ядер происходит периодическое изменение:
- • свойств атомов (радиусов, электроотрицательности, степеней окисления);
- • свойств образуемых элементами простых веществ (металлических и неметаллических, окислительных и восстановительных);
- • свойств сложных веществ (окислительно-восстановительных и кислотно-основных свойств оксидов, гидроксидов, а также водородных соединений).
Вопросы, задания, задачи
1. Расположите в порядке возрастания атомных радиусов элементы: Cl, N, Si, He, Li, Al. Дайте объяснение.
2. Объясните, почему атомный радиус при переходе:
- а) от алюминия к кремнию уменьшается;
- б) от неона к натрию резко возрастает.
3. Используя закономерности в изменении атомных радиусов, объясните изменение электроотрицательности атомов в ряду элементов:
- а) F, Cl, Br, I;
- б) S, P, Si.
4. Вам известно, что сходство свойств элементов одной и той же группы объясняется одинаковым числом валентных электронов. Укажите, чем обусловлено различие свойств элементов одной группы.
5. Укажите максимальные и минимальные степени окисления атомов: Ca, Cl, K, Na, Mg, Si, P.
6. Нарисуйте в тетради и заполните таблицу «Изменение свойств атомов и их соединений по периодам и группам».
| Свойства | Характер изменения при движении в таблице | |
| По периоду |
По группе |
|
| Заряд ядра атома | ||
| Число электронных слоёв в атоме | ||
| Число электронов на внешнем слое атома | ||
| Радиус атома | ||
| Электроотрицательность | ||
| Способность притягивать электроны | ||
| Способность отдавать электроны | ||
| Металлические свойства простых веществ | ||
| Неметаллические свойства простых веществ | ||
| Основные свойства оксидов и гидроксидов элементов | ||
| Кислотные свойства оксидов и гидроксидов | ||
7. Из предложенного перечня характеристик выберите те, которые линейно (а не периодически) изменяются с ростом заряда ядра атома: электроотрицательность, число протонов, радиус атома, масса атома, общее число электронов, число электронов на внешнем слое, степень окисления.
8. Для азота характерны следующие степени окисления: +5, +4, +3, +2, +1, 0, –1, –2, –3. Какие свойства — окислительные или восстановительные — выражены у азота в каждой из этих степеней окисления?
9. Исходя из положения элементов N, P, С, Al, S в периодической системе, сравните кислотные свойства:
- а) HNO3 и H3PO4;
- б) Al(OH)3 и H3PO4;
- в) H3PO4 и H2SO4.
10. Массы двух водородных соединений равны. Сравните численно их объёмы при н. у., если известно, что оба соединения газообразны и образованы элементами с конфигурацией [Ne]3s23p5 и [He]2s22p3.
*Самоконтроль
1. Состав высших оксидов выражается общей формулой ЭО3 для элементов:
- а) С;
- б) S;
- в) Se;
- г) Cr.
2. Электроотрицательность элементов возрастает в рядах:
- а) С, F, Cl;
- б) S, Cl, F;
- в) S, O, F;
- г) C, O, N.
3. Осно́вные свойства веществ сначала возрастают, а затем убывают в рядах:
- а) MgO, BeO, Li2O;
- б) Al(ОН)3, Mg(ОН)2, Be(ОН)2;
- в) ZnO, K2O, CuO;
- г) LiОН, NaОН, Mg(OН)2.
4. Металлические свойства у первого простого вещества выражены сильнее, чем у второго, в паре:
- а) Са и K;
- б) Ва и Ra;
- в) Li и Ве;
- г) Fe и Ca.
5. Кислотные свойства наиболее сильно выражены у гидроксида:
- а) Н2СО3;
- б) Н2SiО3;
- в) Al(ОН)3;
- г) НСlО4.