§ 11. Периодичность изменения свойств атомов химических элементов и образуемых ими веществ
Периодичность изменения радиусов атомов элементов
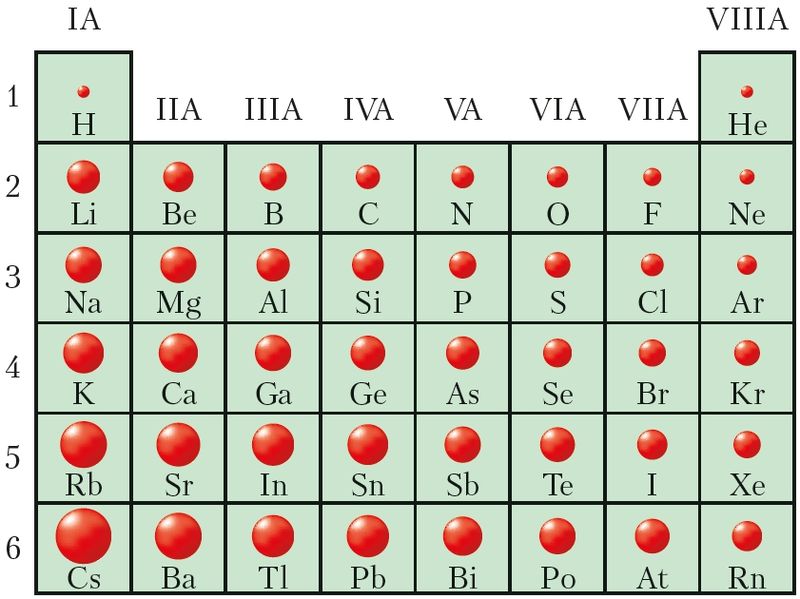
Радиус атома определяется размером его электронной оболочки. С точки зрения вероятности нахождения электрона в околоядерном пространстве атом не имеет чётких границ. Поэтому радиус атома — это условная величина. За радиус атома будем принимать расстояние от ядра до внешней электронной оболочки, занятой электронами. Как указано в § 9, в сфере с таким радиусом сосредоточено около 90 % электронной плотности.
Сопоставив характер изменения радиусов атомов (рис. 21) с их электронным строением, можно сделать следующие выводы:
- • в периоде радиусы атомов уменьшаются, так как с ростом заря а ядра электроны сильнее притягиваются к ядру;
- • в группе радиусы атомов увеличиваются из-за роста числа электронных слоёв;
- • изменение значений радиусов атомов с ростом заряда ядра носит периодический характер. В пределах каждого периода наибольшим радиусом обладают атомы щелочных металлов, а наименьшим — атомы благородных газов.
Значения радиусов атомов являются важной характеристикой химических элементов, поскольку они определяют связь внешних, валентных, электронов с атомом. Чем меньше радиус, тем сильнее валентные электроны удерживаются в атоме и наоборот.
Силы притяжения или отталкивания заряженных частиц определяются законом Кулона: сила взаимодействия двух заряженных тел прямо пропорциональна произведению модулей их зарядов и обратно пропорциональна квадрату расстояния между ними: