§ 10. Периодический закон в свете теории строения атома
Вопросы, задания, задачи
1. Поясните на примере азота физический смысл порядкового номера химического элемента, номера А-группы, номера периода.
2. Почему элементы IА- и IIА-групп называют s-элементами, а элементы IIIА–VIIIА-групп — p-элементами?
3. Постройте электронно-графические схемы и запишите электронные формулы атомов химических элементов 3-го периода.
4. Почему свойства химических элементов и их соединений подчиняются периодическому закону? Обоснуйте свой ответ.
5. Почему элементы одной группы проявляют сходство в свойствах? В чём причина различия свойств химических элементов, расположенных в одной группе?
6. Из анализа приведённых электронно-графических схем, отметьте, какие состояния атома являются основными, а какие возбуждёнными:
- а)
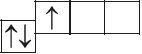
- б)
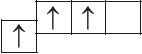
- в)
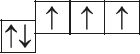
- г)
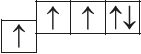
- д)
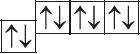
7. Определите число энергетических уровней, на которых в атомах кислорода, магния, кальция и свинца в основном состоянии расположены электроны.
8. Укажите:
- а) число электронов на внешней электронной оболочке у атомов химических элементов с порядковыми номерами 5, 15, 20, 32, 53;
- б) символы элементов, в атомах которых полностью заполнены внешние электронные оболочки.
9. Определите массу соли, полученной при растворении в кислоте состава НЭ металла Ме массой 5 г. При этом известно, что элемент, входящий в состав кислоты имеет электронную конфигурацию [Ne]3s23p5, а электронная схема металла 2е–, 8е–, 2е–.
10. Составьте электронно-графическую схему атома химического элемента Э, соединения которого широко используются в сельском хозяйстве. Одно из них имеет состав (ЭН2)2СО, а массовая доля элемента в нём равна 46,67 %.