§ 10. Периодический закон в свете теории строения атома
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 10. Периодический закон в свете теории строения атома |
| Напечатано:: | Гость |
| Дата: | Sunday, 2 November 2025, 06:56 |

В ходе кропотливого труда по систематизации свойств простых и сложных веществ профессор Санкт-Петербургского университета Д. И. Менделеев обнаружил периодическую зависимость состава высших оксидов и водородных соединений химических элементов от их атомной массы. Расположив символы химических элементов в порядке возрастания атомной массы и объединив элементы с одинаковой формулой высшего оксида в группы, в 1869 году Д. И. Менделеев создал таблицу, которую назвал периодической. Оказалось, что элементы, объединённые в одну группу по признаку общей валентности, имеют близкие химические свойства. На основе установленной закономерности он сформулировал закон, который получил название периодического.
В отличие от физических законов, которые обычно представляются в виде формул, периодический закон был отображён Д. И. Менделеевым в виде периодической системы химических элементов.
В 1913 году было экспериментально установлено, что химический элемент — это вид атомов с определённым положительным зарядом ядра, значение которого соответствует порядковому номеру химического элемента в периодической системе. После этого периодический закон получил новую формулировку:
свойства атомов химических элементов, а также состав и свойства образуемых ими веществ находятся в периодической зависимости от заряда атомных ядер.
Таким образом, порядковый номер химического элемента приобрёл физический смысл. Как вы уже знаете, если за единицу измерения заряда принять заряд электрона, то относительный заряд ядра любого атома будет численно равен порядковому номеру Z соответствующего химического элемента.
Следующим этапом развития теории периодической системы стало выяснение причины периодической зависимости свойств химических элементов от заряда ядра атомов, обоснование интервалов периодичности.

Последовательность
заполнения
электронами атомных
орбиталей
Для выяснения этих причин давайте проследим, как по мере возрастания заряда атомных ядер изменяются состояния электронов в атомах химических элементов. Для каждого элемента запишем формулу электронной конфигурации и построим электронно-графическую схему в соответствии с рисунком 20.
При решении вопроса о последовательности заполнения электронами атомных орбиталей будем руководствоваться следующими правилами.
1. Электроны в атоме в первую очередь заполняют свободные атомные орбитали с наиболее низкой энергией. Энергия атомных орбиталей возрастает в следующей последовательности:
1s < 2s <2p < 3s < 3p < 4s < 3d < 4p…
2. На одной атомной орбитали может находиться не более двух электронов, причём электроны должны иметь антипараллельные спины.
3. Число неспаренных электронов на данном энергетическом подуровне должно быть максимальным.
Состояние атома, у которого атомные орбитали заполнены электронами в указанной последовательности, является основным состоянием, то есть состоянием с наименьшей энергией. Все остальные состояния будут возбуждёнными.
Итак, у атома водорода с относительным зарядом ядра Z = 1 единственный электрон должен занять самую низкую по энергии атомную орбиталь 1s. У атома следующего элемента оба электрона заселяют ту же 1s-орбиталь, но должны иметь противоположные спины:
Так как на первом энергетическом уровне есть только одна атомная орбиталь, которая не может вместить более двух электронов, то третий и четвёртый электроны в атомах с Z = 3 и Z = 4 занимают следующую по энергии 2s-орбиталь. Атомы этих элементов начинают второй период:


В атомах следующих элементов электроны заполняют 2p-подуровень: сначала по одному электрону на каждую из трёх р-орбиталей; затем, начиная с атома кислорода (Z = 6), каждая р-орбиталь заполняется вторым электроном:






Так как второй энергетический уровень не может содержать более 8 электронов, то элемент с относительным зарядом ядра атома +11 (Z = 11) начинает третий период:

Последовательность заполнения электронами атомных орбиталей на третьем энергетическом уровне аналогична той, что мы наблюдали для второго уровня (Приложение 1). Состояние электронов последнего элемента третьего периода аргона (Z = 18) описывается так:

При этом у атома Ar, в отличие от атомов предыдущих благородных газов He и Ne, не заканчивается заполнение электронами третьего энергетического уровня. У него остаются незаполненными 3d-орбитали. Поскольку на внешнем электронном слое не может быть более 8 электронов, то cледующий за аргоном элемент (Z = 19) начинает новый, четвёртый период.
Для компактности записи заполненные электронные оболочки в формулах электронных конфигураций заменим символом благородного газа, атом которого имеет такую же электронную конфигурацию. Так, запись 1s2 можно заменить на [He], 1s22s22p6 — на [Ne], 1s22s22p63s23p6 — на [Ar] и т. д. Например, формулу электронной конфигурации атома лития можно записать как [He]2s1, хлора — [Ne]3s23p5.
На этом остановим рассмотрение электронных конфигураций атомов химических элементов.
Сопоставив формулы электронных конфигураций атомов с положением соответствующих им химических элементов в периодической системе, можно обратить внимание на следующие закономерности.
Во-первых, начало каждого периода совпадает с началом заполнения нового энергетического уровня в атоме. Значение номера этого уровня (n) равно номеру периода. В этом заключается физический смысл номера периода.
Во-вторых, число электронов на внешней электронной оболочке атома А-группы равно номеру группы, в которой размещён соответствующий этому атому химический элемент. В этом заключается физический смысл номера группы. Максимальное число электронов на внешней электронной оболочке атомов не превышает восьми (табл. 6).
Таблица 6. Электронная конфигурация атомов химических элементов А-групп
| Параметры сравнения | Группы | |||||||
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | VIIIA | |
| Внешняя оболочка | ns1 | ns2 | ns2np1 | ns2np2 | ns2np3 | ns2np4 | ns2np5 | ns2np6 |
| Число e– на внешней оболочке | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Высший оксид | R2O | RO | R2O3 | RO2 | R2O5 | RO3 | R2O7 | — |
| Водородное соединение | RH | RH2 | RH3 | RH4 | RH3 | RH2 | RH | — |
Третья закономерность следует из анализа следующей логической схемы, которую мы построим с учётом знаний, полученных в 8–10-х классах.
Четвёртую закономерность нам позволит сделать логическая схема.
Проведённое сопоставление позволяет заключить: свойства химических элементов изменяются периодически потому, что периодически изменяется электронная конфигурация внешней электронной оболочки их атомов.
*Электронные конфигурации атомов элементов четвёртого периода
Согласно схеме распределения атомных орбиталей по энергии, изображённой на рисунке 18, энергия 3d-орбиталей выше, чем 4s-орбиталей, поэтому в атоме калия последний электрон занимает более низкую по энергии 4s-орбиталь с образованием электронной конфигурации 1s22s22p63s23p64s1. Аналогично происходит и с последними двумя электронами атома кальция. При этом формируется электронная конфигурация 1s22s22p63s23p64s2.
У атомов элементов, следующих за кальцием в 4-м периоде, энергетически предпочтительнее заполнение электронами не 4p-, а 3d-подуровня.
Принцип заполнения электронами 3d-орбиталей тот же, что для s- и p-орбиталей: по мере накопления электроны по очереди заполняют 3d-орбитали сначала по одному электрону, после заполнения всех орбиталей — по второму. Так, электронная конфигурация атома железа с шестью электронами на 3d-подуровне описывается формулой 1s22s22p63s23p63d64s2.
Нарушается порядок заполнения электронами атомных орбиталей в атомах хрома и меди. Для них энергетически более устойчивы состояния с одним электроном на 4s-орбитали: Cr — 1s22s22p63s23p63d54s1, Cu — 1s22s22p63s23p63d104s1.
Электроны в атоме цинка завершают заполнение 3d-подуровня, и у следующего за ним элемента галлия начинает заполняться следующий по возрастанию энергии 4p-подуровень. Заполнение этого подуровня заканчивается у атома благородного газа криптона. Формула электронной конфигурации Kr — 1s22s22p63s23p63d104s24p6.
Так как у атомов от скандия до цинка происходит последовательное заполнение электронами 3d-подуровня, их называют d-элементами. Ввиду того что существует пять d-орбиталей, в 4-м и каждом последующем периоде имеется по десять d-элементов. Формулы электронных конфигураций для d-элементов 4-го периода приведены в таблице 5.1.
Таблица 5.1. Электронные конфигурации атомов элементов 4-го периода
| Электронная схема | Формула электронной конфигурации |
| 19K 2e–, 8e–, 8e–, 1e– | 19K 1s22s22p63s23p64s1 |
| 20Са 2e–, 8e–, 8e–, 2e– | 20Са 1s22s22p63s23p64s2 |
| 21Sc 2e–, 8e–, 9e–, 2e– | 21Sc 1s22s22p63s23p63d14s2 |
| 22Тi 2e–, 8e–, 10e–, 2e– | 22Тi 1s22s22p63s23p63d24s2 |
| 23V 2e–, 8e–, 11e–, 2e– | 23V 1s22s22p63s23p63d34s2 |
| 24Cr 2e–, 8e–, 13e–, 1e– | 24Cr 1s22s22p63s23p63d54s1 |
| 25Mn 2e–, 8e–, 13e–, 2e– | 25Mn 1s22s22p63s23p63d54s2 |
| 26Fe 2e–, 8e–, 14e–, 2e– | 26Fe 1s22s22p63s23p63d64s2 |
| 27Co 2e–, 8e–, 15e–, 2e– | 27Co 1s22s22p63s23p63d74s2 |
| 28Ni 2e–, 8e–, 16e–, 2e– | 28Ni 1s22s22p63s23p63d84s2 |
| 29Cu 2e–, 8e–, 18e–, 1e– | 29Cu 1s22s22p63s23p63d104s1 |
| 30Zn 2e–, 8e–, 18e–, 2e– | 30Zn 1s22s22p63s23p63d104s2 |
| 31Ga 2e–, 8e–, 18e–, 3e– | 31Ga 1s22s22p63s23p63d104s24р1 |
| 32Ge 2e–, 8e–, 18e–, 4e– | 32Ge 1s22s22p63s23p63d104s24р2 |
| 33As 2e–, 8e–, 18e–, 5e– | 33As 1s22s22p63s23p63d104s24р3 |
| 34Se 2e–, 8e–, 18e–, 6e– | 34Se 1s22s22p63s23p63d104s24р4 |
| 35Br 2e–, 8e–, 18e–, 7e– | 35Br 1s22s22p63s23p63d104s24р5 |
| 36Kr 2e–, 8e–, 18e–, 8e– | 36Kr 1s22s22p63s23p63d104s24р6 |
Порядок расположения 3d- и 4s-орбиталей в атомах установлен экспериментально. Исходя из этих данных, при отрыве от атома электронов ns2-электроны отрываются раньше, чем (n–1)d-электроны, что приводит к обычной для d-элементов степени окисления +2. Из этого следует, что ns-электронный слой является внешним по отношению к (n–1)d-электронному слою.
Структура периодической системы химических элементов с точки зрения строения атомов
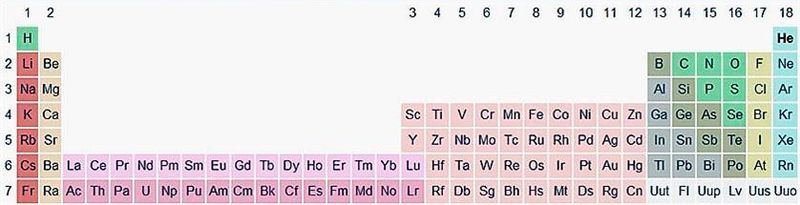
Основными структурными составляющими периодической системы химических элементов являются группа и период. Группа — это вертикальный ряд элементов, расположенных в порядке возрастания заряда ядра их атомов, объединённых общим признаком — однотипной электронной конфигурацией внешней электронной оболочки.
Элементы IА- и IIА-групп относят к s-элементам, поскольку у них электроны внешней оболочки находятся на s-подуровне. Элементы IIIА–VIIIА-групп — соответственно к p-элементам. Элементы, расположенные в периодической системе между s- и p-элементами в 4–8-м периодах, называются d- и f-элементами. У них электронами заполняется d- и f-подуровни предвнешней электронной оболочки. Такие элементы относят к B-группам.
Периоды — это горизонтальные ряды в периодической системе, в которых химические элементы расположены в порядке увеличения заряда ядра атома и числа электронов на внешнем энергетическом уровне. У атомов элементов 2-го и 3-го периодов происходит постепенное заполнение электронами s-, а затем p-орбиталей.
Каждый период начинается s-элементами (щелочные металлы), в атомах которых электроны заполняют новый энергетический уровень. Последним элементом в каждом периоде является благородный газ, атомы которого имеют полностью заполненный электронами р-подуровень.
Таким образом, развитие теории строения атома позволило дать физическое обоснование периодическому закону и структуре периодической системы химических элементов. В настоящее время периодическую систему можно рассматривать как естественную классификацию химических элементов по электронным структурам их атомов.
*Положение в периодической системе d- и f-элементов
d- и f-Элементы относят к элементам B-групп. Так как эти элементы расположены в периодической системе между s- и p-элементами в 4–8-м периодах, их называют переходными.
В 4-м периоде (K — Kr) содержится 18 элементов. Ввиду большего числа элементов в этом периоде по сравнению с первыми тремя периодами Д. И. Менделеев назвал 4-й и последующие периоды большими.
Пятый период (Rb — Xe) построен аналогично 4-му: в нём также находится десять переходных d-элементов (Y — Cd).
Шестой период (Cs — Rn) содержит 32 элемента. В него, помимо десяти d-элементов (Lu — Hg), включено 14 f-элементов. Элементы от лантана (La) до иттербия (Yb) в виде отдельного ряда вынесены вниз таблицы, который получил название «лантаноиды» по его первому элементу — лантану. Лантаноиды сходны по химическим свойствам. Это объясняется тем, что электронами у них заполняются внутренние 4f-орбитали, а валентный электронный слой имеет похожую электронную конфигурацию — чаще всего 5d16s2. В соединениях лантаноиды проявляют преимущественно степень окисления +3.
Седьмой период также содержит 32 элемента — от франция (Fr) до оганесона (Og). Период начинается с s-элементов (Fr и Ra), затем следуют 14 актиноидов (Ac — No). Эти элементы также вынесены в отдельный ряд внизу таблицы из-за близости их свойств, хотя они выражены меньше, чем у лантаноидов. Затем следуют десять 6d-элементов и шесть 6р-элементов. Все элементы этого периода являются радиоактивными, и большая их часть получена искусственным путём.
В периодической системе элементы разделены на группы. Две группы IA и IIA заполняют s-элементы. Далее располагаются десять В-групп, заполненных d-элементами. Завершают таблицу шесть А-групп, содержащих р-элементы.
Может ли быть открыто ещё больше химических элементов, чем известно сейчас? Ведь самые последние из известных элементов были открыты совсем недавно.
На этот вопрос отвечает теория ядерной физики. Пока с надёжностью предсказывают возможность существования химических элементов с порядковыми номерами до 126. В то же время есть научные концепции, которые предполагают искусственное получение химических элементов с порядковыми номерами до 173 с «островком стабильности» в области 164-го элемента.
У периодического закона нет привычного для физических законов математического выражения. Все попытки вывести математическую формулу периодического закона, предпринимавшиеся неоднократно, оказались безуспешными. В этом особенность свойств химических элементов и их соединений. Присущие им свойства не укладываются в простые математические выражения.
Своеобразной графической формой, выражающей периодический закон, стала периодическая система, которую Д. И. Менделеев представил в виде таблицы. По предложению ИЮПАК её так и называют: «Периодическая таблица элементов» (Periodic Table of the Elements), а у нас часто кратко: «Таблица Менделеева».
Таблица периодической системы — это иллюстрация закономерного расположения химических элементов относительно друг друга в периодической системе.
Менделеев посчитал более приемлемым представить периодическую систему в короткопериодной форме, которая в современном виде изображена на рисунке 20.1. В ней группы элементов подразделяются на подгруппы — главные и побочные. В главных подгруппах размещены s- и p-элементы, в побочных — d-элементы.
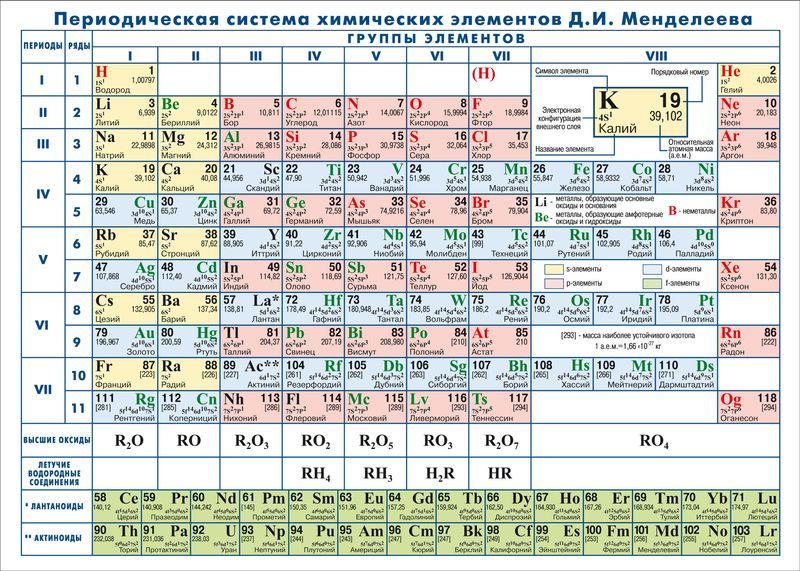
Позже ИЮПАК предложил использовать полудлиннопериодный вариант таблицы, в котором главные и побочные подгруппы были преобразованы в отдельные А- и В-группы: главные — в А-группы, побочные — в В-группы. Таких групп оказалось 18. Эта таблица изображена на форзаце учебника.
Существует вариант длиннопериодной таблицы, в которой f-элементы встроены в ряд с d-элементами (рис. 20.2). Существуют и другие варианты изображения периодической системы, их насчитывается около 500.
Свойства атомов химических элементов, а также состав и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от заряда атомных ядер.
Порядковый номер химического элемента равен числу протонов в ядре атома этого элемента.
Номер А-группы соответствует числу электронов на внешней электронной оболочке атомов химических элементов данной группы. Элементы, находящиеся в одной группе периодической системы, имеют одинаковую электронную конфигурацию внешнего электронного слоя.
Номер периода совпадает с числом энергетических уровней, на которых размещены электроны в атомах всех элементов этого периода.
Вопросы, задания, задачи
1. Поясните на примере азота физический смысл порядкового номера химического элемента, номера А-группы, номера периода.
2. Почему элементы IА- и IIА-групп называют s-элементами, а элементы IIIА–VIIIА-групп — p-элементами?
3. Постройте электронно-графические схемы и запишите электронные формулы атомов химических элементов 3-го периода.
4. Почему свойства химических элементов и их соединений подчиняются периодическому закону? Обоснуйте свой ответ.
5. Почему элементы одной группы проявляют сходство в свойствах? В чём причина различия свойств химических элементов, расположенных в одной группе?
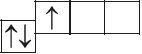
6. Из анализа приведённых электронно-графических схем, отметьте, какие состояния атома являются основными, а какие возбуждёнными:
- а)
- б)
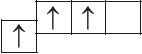
- в)
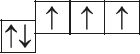
- г)
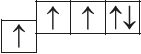
- д)
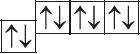
7. Определите число энергетических уровней, на которых в атомах кислорода, магния, кальция и свинца в основном состоянии расположены электроны.
8. Укажите:
- а) число электронов на внешней электронной оболочке у атомов химических элементов с порядковыми номерами 5, 15, 20, 32, 53;
- б) символы элементов, в атомах которых полностью заполнены внешние электронные оболочки.
9. Определите массу соли, полученной при растворении в кислоте состава НЭ металла Ме массой 5 г. При этом известно, что элемент, входящий в состав кислоты имеет электронную конфигурацию [Ne]3s23p5, а электронная схема металла 2е–, 8е–, 2е–.
10. Составьте электронно-графическую схему атома химического элемента Э, соединения которого широко используются в сельском хозяйстве. Одно из них имеет состав (ЭН2)2СО, а массовая доля элемента в нём равна 46,67 %.
*Самоконтроль
1. В периодической зависимости от заряда ядра атомов находится:
- а) масса атомов;
- б) общее число электронов в атоме;
- в) электронная конфигурация внешнего электронного слоя;
- г) размеры атомов.
2. Атому магния соответствуют формулы электронных конфигураций:
- а) 1s22s22p63s2;
- б) 1s22s22p63s23p2;
- в) [Ne]3s23p;
- г) [Ne]3s2.
3. Общая формула электронной конфигурации элементов IIIА-группы:
- а) ns2np1;
- б) ns2np2;
- в) ns2np3;
- г) ns2np4.
4. Формулы электронных конфигураций благородных газов:
- а) 1s2;
- б) 2s22p6;
- в) 1s22s22p63s23p6;
- г) 1s23s23p63s23p64s2.
5. Два неспаренных электрона на внешнем электронном слое в основном состоянии имеют атомы:
- а) С;
- б) N;
- в) О;
- г) Ne.