§ 9. Состояние электрона в атоме

а — изображение, б — дифракционная картина.
Фотографии получены методами, основанными
на использовании волновых свойств электронов
Развитие квантовой механики в 20-х годах ХХ века привело к коренному пересмотру фундаментальных понятий теории строения атома. Исследование свойств электрона показало, что ему присущи свойства как частицы, так и волны. Электрон как частица характеризуется массой и электрическим зарядом, как волна — длиной волны, которая зависит от скорости движения электрона. Эту двойственность свойств электрона назвали корпускулярно-волновым дуализмом.
В настоящее время волновые свойства электрона используются в электронной и атомно-силовой микроскопии, позволяющей рассматривать различные объекты (размером порядка 10–9 м) с увеличением в сотни тысяч раз (рис. 15). Без этих методов было бы невозможным появление нанотехнологий.
Электронное
облако атома
водорода
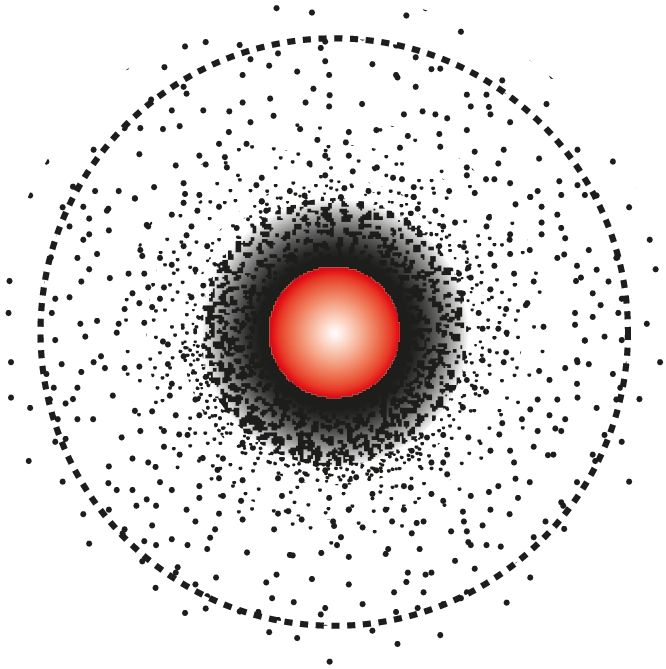
С точки зрения квантовой механики для электрона нельзя одновременно точно определить его координату и скорость, а следовательно, невозможно проследить траекторию движения электрона в атоме, поэтому говорят о вероятности нахождения электрона в определённой области пространства около ядра. Её ограничивают условной поверхностью, охватывающей примерно 90 % объёма, в котором наиболее велика вероятность нахождения данного электрона (рис. 16). Такую область околоядерного пространства называют атомной электронной орбиталью, или просто атомной орбиталью.
Каждому электрону в атоме соответствует своя атомная орбиталь, которая характеризуется определёнными значениями энергии, формой и размером электронного облака.
За условный размер атомной s-орбитали принимают диаметр облака, в котором вероятность нахождения данного электрона составляет примерно 90 % (см. пунктирную линию на рис. 16).
По форме электронного облака различают s-, p-, d- и f-орбитали. s-Орбитали имеют форму сферы, р — форму гантели, d и f — более сложную форму (рис. 17).
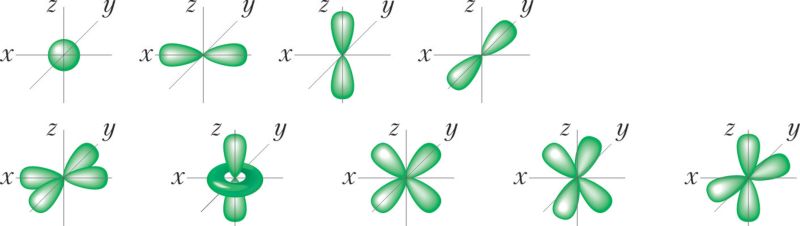
и d-орбиталей (нижняя строка)
атомных орбиталей по энергии
(энергетическая диаграмма)
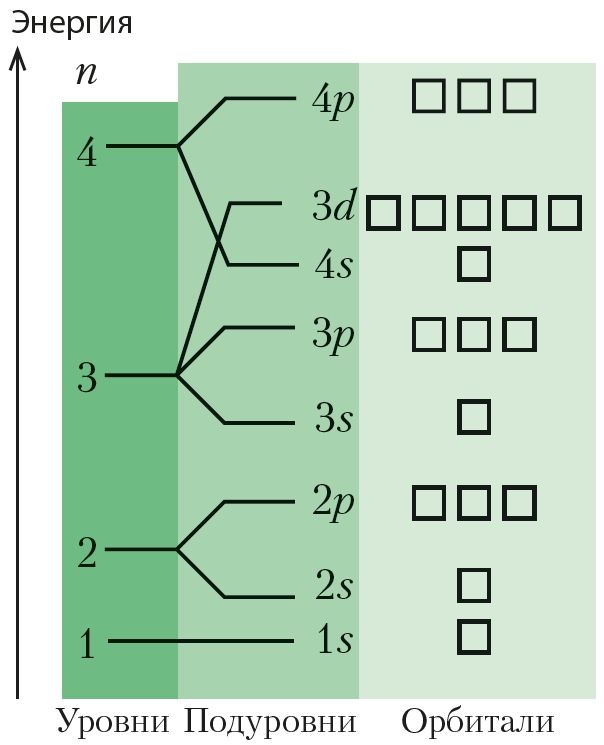
Согласно основному принципу квантовой механики, электрон в атоме может принимать только определённые значения энергии, а другие значения запрещены. В этом случае говорят, что энергия электрона квантована, то есть имеет дискретный набор значений. Для наглядного представления состояний электронов в атоме используют энергетическую диаграмму (рис. 18). Проанализируем этот рисунок. Из рисунка следует, что электроны в атоме распределены по энергетическим уровням и подуровням.
Энергетические уровни (или электронные слои, с которыми вы ознакомились, изучая химию в 9-м классе) обозначают числом n. Это число имеет только целочисленные значения: 1, 2, 3, … Каждому значению n соответствует определённое значение энергии электрона. Энергия может изменяться только скачкообразно. Самый низкий энергетический уровень (n = 1) соответствует минимально возможной энергии электрона. Находящиеся на этом уровне электроны наиболее сильно связаны с ядром. Чем больше n, слабее его связь с ядром, больше размер электронного облака, тем больше энергия электрона. При n = ∞ электрон теряет связь с ядром и считается свободным.
Вам уже известно, что число электронов на энергетических уровнях различно. Так, на первом энергетическом уровне может быть не более 2, на втором — не более 8, на третьем — не более 18 электронов.
Число электронов, которое может вместить определённый уровень, можно вычислить по формуле:
N(e–) = 2n2.
Электроны, находящиеся на одном энергетическом уровне, образуют электронную оболочку, или слой. Высшую по энергии электронную оболочку называют внешней. На ней расположены электроны, которые слабее всего связаны с ядром и поэтому способны участвовать в образовании химических связей. Их называют валентными.
В многоэлектронных атомах энергетические уровни расщепляются на энергетические подуровни (табл. 5). На первом уровне (n = 1) есть только один подуровень — 1s, на втором (n = 2) — два подуровня (2s и 2p), на третьем — их три (3s, 3p и 3d).
Таблица 5. Распределение электронов в атоме по уровням, подуровням, орбиталям
| Энергетический уровень, n | Подуровень | Число атомных орбиталей | Максимальное число электронов на подуровне | Максимальное число электронов на энергетическом уровне (N(e–) = 2n2) |
| 1 | 1s | 1 | 2 | 2 |
| 2 |
2s 2p |
1 3 |
2 6 |
8 |
| 3 |
3s 3p 3d |
1 3 5 |
2 6 10 |
18 |