§ 4. Количественные характеристики вещества
Молярная масса
Использование единицы измерения количества вещества позволяет взвешивать вещества определёнными порциями количеством 1 моль или несколько молей. Масса одного моля вещества численно равна молярной массе М. Её также можно рассчитать делением массы порции вещества m на его химическое количество (число молей):
Таким образом, молярная масса — величина, равная отношению массы порции вещества к его химическому количеству.
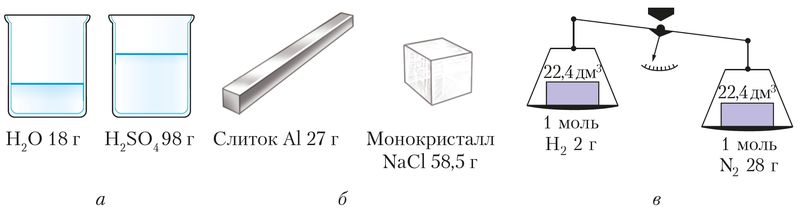
Размерность молярной массы — кг/моль, но химики чаще пользуются дольной единицей г/моль. Численно молярная масса равна относительной молекулярной (формульной) массе. Справедливо только численное равенство, поскольку речь идёт о разных физических величинах. Молярная масса характеризует порцию вещества, содержащую 6,02 ∙ 1023 частиц, относительная молекулярная масса — одну частицу (молекулу, формульную единицу и др.). Например, Mr(СО2) = 44, значит, M(СО2) = 44 г/моль. Молярная масса зависит как от количественного, так и от качественного состава вещества (рис. 8).
а — жидких, б — твёрдых, в — газообразных
Зная требуемое для химической реакции количество вещества, легко рассчитать его массу по формуле:
Так, например, для синтеза нужен оксид меди(II) количеством 0,25 моль. Поскольку молярная масса M(CuO) = 80 г/моль, то масса его порции составляет: m(CuO) = M(CuO) ∙ n(CuO) = 0,25 моль ∙ 80 г/моль = 20 г, то есть экспериментатор должен взвесить 20 г оксида меди(II).
Помимо молярной массы, каждое вещество имеет молярный объём Vm, то есть объём вещества количеством 1 моль.
Молярный объём газа Vm — величина, равная отношению объёма данной порции вещества V(Х) к его химическому количеству n(Х) в этой порции:
Молярный объём твёрдых веществ и жидкостей зависит от их плотности. Молярный объём воды, кислоты, металла и соли различен, потому что их плотности тоже отличаются (рис. 8). Молярный объём вещества можно также рассчитать, применив известную формулу :
где ρ — плотность вещества.
Например, молярный объём уксусной кислоты:
Рассчитаем молярный объём двух произвольно выбранных газов — азота и метана (при нормальных условиях):
Итак, два произвольно выбранных различных газообразных вещества — метан и азот — количеством 1 моль при одинаковых условиях занимают один и тот же объём. Это характерно и для любых других газов. При нормальных условиях молярный объём газа Vm = 22,4 дм3/моль.
Напомним, что нормальные условия — это температура 0 °С (273 K), давление — 101,325 кПа.
Равенство объёмов разных газов количеством 1 моль, измеряемых в одних и тех же условиях, объясняется одинаковым числом молекул в случае обоих газов и одним и тем же расстоянием между молекулами. В газах, в отличие от жидких и твёрдых веществ, размеры молекул не оказывают значительного влияния на молярный объём.
Систематизируем важнейшие количественные характеристики вещества и их смесей (табл. 3).
Таблица 3. Количественные характеристики вещества, порции вещества и вещества в смеси
| Количественные характеристики | |||||
| Вещество | Порция вещества | ||||
| Величина | Обозначение и единицы измерения | Величина | Обозначение и единицы измерения | ||
| Относительная молекулярная (формульная) масса | Mr | — | Масса | m | кг, г |
| Молярная масса | M | г/моль | Объём | V | м3 |
| Молярный объём | Vm | дм3/моль | Количество вещества | n | моль |
| Плотность | ρ | кг/м3 | Число структурных единиц (частиц) | N | — |
| Массовая доля элемента | ω | —; % | |||
| Вещество в смеси | |||||
| Массовая доля вещества | ω | —; % | Молярная концентрация вещества | с | моль/дм3 |
| Объёмная доля вещества | φ | —; % | |||