§ 3.4. Соли
Классификация и номенклатура
В зависимости от полноты замещения атомов водорода в кислотах или гидроксогрупп в составе оснований различают средние, кислые и основные соли. Кислые соли могут образовывать только многоосновные кислоты (Н2SO4, Н2СO3, Н2S, Н3РO4), основные соли — только многокислотные основания (Mg(OH)2, Cu(OH)2, Al(OH)3).
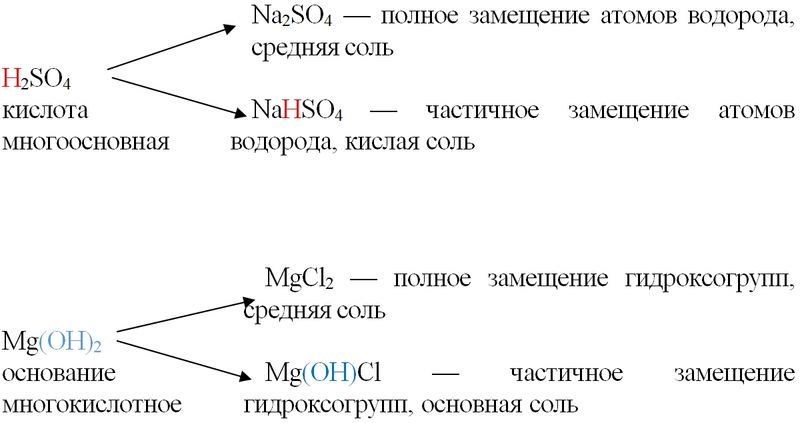
В основе систематических названий солей лежат названия кислотных остатков: MgSO4 — сульфат магния, Fe2(SO4)3 — сульфат железа(III). В названия основных солей перед названием металла добавляют слово «гидроксо»: Mg(OH)Cl — хлорид гидроксомагния, (СuOH)2CO3 — карбонат гидроксомеди(II) (малахит). Кислые соли называют, добавляя перед названием кислотного остатка слово «гидро-»: NaHCO3 — гидрокарбонат натрия (питьевая сода).
Твёрдые соли часто в своём составе содержат воду, и в этом случае их называют кристаллогидратами: FeSO4 ∙ 7H2O, Na2СO3 ∙ 10H2O. В их названиях указывают число молекул воды, приходящихся на одну формульную единицу безводной соли: CuSO4 ∙ 5H2O — пентагидрат сульфата меди(II), Na2SO4 ∙ 10H2O — декагидрат сульфата натрия. Их тривиальные названия — медный купорос, мирабилит (глауберова соль).
Отдельную группу солей образуют комплексные соединения. В школьном курсе вы встретите небольшое число таких соединений, содержащих сложные, комплексные, ионы. Наиболее часто в состав комплексного иона входят катион металла и связанные с ним анионы или молекулы. При написании химических формул такие ионы заключают в квадратные скобки. Этим подчёркивают особо прочные связи между атомами в комплексном ионе. Примерами могут служить:
- Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
- K3[Al(OH)6] — гексагидроксоалюминат калия;
- K[Al(OH)4] — тетрагидроксоалюминат калия.
В курсе органической химии вы ознакомились с солями карбоновых кислот (ацетат натрия СН3СООNa, стеарат калия C17H35COOK (жидкое мыло)) и солями аминов (хлорид метиламмония СН3NH3Cl, гидросульфат фениламмония С6Н5NH3HSO4).