§ 3.4. Соли
| Сайт: | Профильное обучение |
| Курс: | Химия. 11 класс |
| Книга: | § 3.4. Соли |
| Напечатано:: | Гость |
| Дата: | Thursday, 30 October 2025, 17:06 |
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
С позиций теории электролитической диссоциации солями называют сложные вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков. К солям также относят неорганические соединения, содержащие ион аммония и кислотный остаток: NH4Cl, (NH4)2SO4.
Классификация и номенклатура
В зависимости от полноты замещения атомов водорода в кислотах или гидроксогрупп в составе оснований различают средние, кислые и основные соли. Кислые соли могут образовывать только многоосновные кислоты (Н2SO4, Н2СO3, Н2S, Н3РO4), основные соли — только многокислотные основания (Mg(OH)2, Cu(OH)2, Al(OH)3).
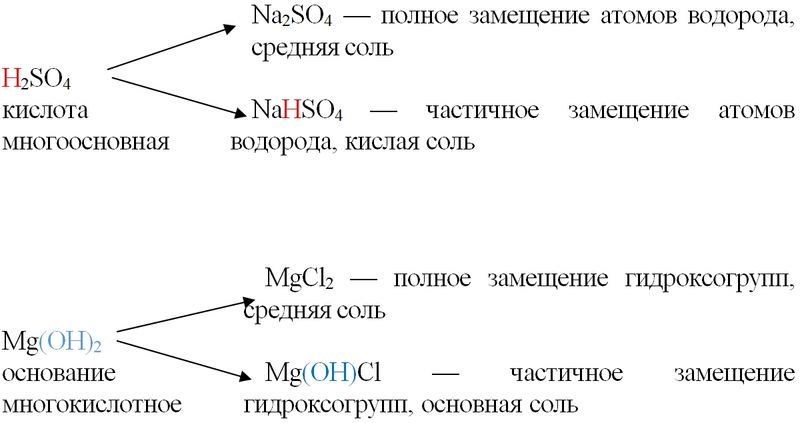
В основе систематических названий солей лежат названия кислотных остатков: MgSO4 — сульфат магния, Fe2(SO4)3 — сульфат железа(III). В названия основных солей перед названием металла добавляют слово «гидроксо»: Mg(OH)Cl — хлорид гидроксомагния, (СuOH)2CO3 — карбонат гидроксомеди(II) (малахит). Кислые соли называют, добавляя перед названием кислотного остатка слово «гидро-»: NaHCO3 — гидрокарбонат натрия (питьевая сода).
Твёрдые соли часто в своём составе содержат воду, и в этом случае их называют кристаллогидратами: FeSO4 ∙ 7H2O, Na2СO3 ∙ 10H2O. В их названиях указывают число молекул воды, приходящихся на одну формульную единицу безводной соли: CuSO4 ∙ 5H2O — пентагидрат сульфата меди(II), Na2SO4 ∙ 10H2O — декагидрат сульфата натрия. Их тривиальные названия — медный купорос, мирабилит (глауберова соль).
Отдельную группу солей образуют комплексные соединения. В школьном курсе вы встретите небольшое число таких соединений, содержащих сложные, комплексные, ионы. Наиболее часто в состав комплексного иона входят катион металла и связанные с ним анионы или молекулы. При написании химических формул такие ионы заключают в квадратные скобки. Этим подчёркивают особо прочные связи между атомами в комплексном ионе. Примерами могут служить:
- Na2[Zn(OH)4] — тетрагидроксоцинкат натрия;
- K3[Al(OH)6] — гексагидроксоалюминат калия;
- K[Al(OH)4] — тетрагидроксоалюминат калия.
В курсе органической химии вы ознакомились с солями карбоновых кислот (ацетат натрия СН3СООNa, стеарат калия C17H35COOK (жидкое мыло)) и солями аминов (хлорид метиламмония СН3NH3Cl, гидросульфат фениламмония С6Н5NH3HSO4).
Физические свойства
Соли — твёрдые кристаллические вещества. Окраска солей может быть обусловлена как ионами металла, так и анионами кислотного остатка (рис. 6.4).

В зависимости от состава соли имеют разную растворимость в воде. Самые простые сведения о ней приведены в «Таблице растворимости солей, кислот, оснований» (см. форзац учебника).
В водном растворе при диссоциации cолей образуются катионы металла и анионы кислотного остатка:
Na2SO4 → 2Na+ + (средняя соль);
NaHCO3 → Na+ + (кислая соль слабой кислоты);
NaHSO4 → Na+ + H+ + (кислая соль сильной кислоты);
Na2[Zn(OH)4] → 2Na+ + [Zn(OH)4]2− (комплексная соль).
Химические свойства солей
К общим химическим свойствам солей относят их взаимодействие с кислотами, щелочами, другими солями и металлами.
| Реагент и уравнение реакции | Особенности реакции |
|---|---|
| 1. Кислота: Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O |
Более сильная кислота вытесняет более слабую из её соли |
| 2. Щёлочь: CuCl2 + 2KOH = Cu(OH)2↓ + 2KCl |
Oбразуется нерастворимое основание и новая соль (сильные основания вытесняют слабые) |
| 3. Соль: BaCl2 + K2SO4 = BaSO4↓ + 2KCl |
Образуются две новые соли, одна из которых нерастворима |
| 4. Металл: CuSO4 + Fe = FeSO4 + Cu↓ |
Более активный металл вытесняет менее активный из раствора его соли |
| 5. Неметалл: Na2S + Cl2 = 2NaCl + S↓ |
Более активный неметалл вытесняет менее активный из раствора его соли |
| 6. Кислотный (амфотерный) оксид: Na2CO3 + SiO2 |
При сплавлении образуется новая соль и летучий оксид |
| 7. Термическое разложение: CaCO3 2Cu(NO3)2 |
При нагревании разлагаются, в основном, карбонаты и нитраты |
Реакции растворов солей с металлами имеют и другие особенности, кроме отмеченных выше. Действительно, более активные металлы вытесняют менее активные. Но если более активным является щелочной или щёлочноземельный металл (Са, Sr, Ba, Ra), то в растворе он в первую очередь реагирует с водой, а образовавшаяся щёлочь может вступить в реакцию с солью. Например, при опускании кусочка натрия в раствор сульфата меди(II) возможны такие реакции:
2Na + 2H2O = 2NaOH + H2↑,
2NaOH + CuSO4 = Cu(OH)2↓ + Na2SO4,
то есть происходит реакция обмена между солью и образовавшейся щёлочью.
Вследствие выделения значительного количества теплоты образующийся гидроксид разлагается до оксида, водород частично восстанавливает оксид:
Cu(OH)2 CuO + 2H2O;
CuO + H2 Cu + H2O.
Дополнительно можно отметить реакции солей бескислородных кислот с неметаллами, кислородсодержащих кислот — с кислотными и амфотерными оксидами, а также термическое разложение некоторых солей.
В главе IV вы рассмотрите ещё одно важное свойство многих солей — способность подвергаться гидролизу.
Получение солей
Способы получения солей многочисленны и разнообразны, при этом они являются отражением химических свойств оксидов, кислот, оснований. Например, некоторые важнейшие способы можно представить как взаимодействие веществ различных классов. Это наглядно иллюстрируют приведённые ниже уравнения реакций.
Вопросы, задания, задачи
1. Выпишите формулы солей: NaOH, Na2SO4, Na2O, Cu(OH)2, CuCl2, Cu(NO3)2.
2. Запишите формулы солей: Mg(OH)NO3, (CuOH)2CO3, NaHCO3, KH2PO4, (NH4)2HPO4. Подчеркните формулы кислых солей.
3. Назовите соли: FeCl2, MgSO4, CaCO3, NaHCO3, Mg(OH)Cl, NaH2PO4.
4. Составьте формулы солей:
- а) фосфат калия, карбонат магния, силикат натрия, сульфат железа(III);
- б) фосфат цинка, сульфат алюминия, нитрат меди(II), хлорид кальция.
5. Составьте уравнения возможных реакций раствора нитрата железа(II) с веществами, формулы которых: Cu, Na, NaOH, Na2SO4, KNO3, HCl.
6. В каждом ряду укажите металл, способный вступать в реакцию замещения с водным раствором соли CuCl2:
- а) Na, Fe, Hg;
- б) Ca, Zn, Ag.
Составьте уравнения соответствующих реакций.
7. Определите массовую долю соли в растворе, полученном при растворении медного купороса массой 25 г в:
- а) воде массой 275 г;
- б) растворе сульфата меди(II) массой 195 г с массовой долей соли 5 %.
8. Определите молярную концентрацию нитрата натрия в растворе:
- а) с массовой долей 18 % и плотностью 1,118 г/см3;
- б) с массовой долей 1 % и плотностью 1,004 г/см3.
9. Предложите пять способов получения соли:
- а) Ca3(PO4)2;
- б) ZnSO4.
10. После прокаливания нитрата меди(II) массой 9,4 г масса твёрдого остатка составила 5,08 г. Определите массу неразложившегося нитрата.
Самоконтроль
1. К солям относят вещества, формулы которых:
- а) СаSO4;
- б) Mg(OH)Cl;
- в) С6Н5ОK;
- г) KH2PO4.
2. При умеренном нагревании разлагаются соли металлов:
- а) сульфаты;
- б) фосфаты;
- в) хлориды;
- г) карбонаты.
3. Хлорид железа(II) может реагировать с:
- а) Zn;
- б) Сu(OH)2;
- в) NaОH;
- г) Pb(NO3)2.
4. Соль не образуется в реакции:
- а) Fe + HCl →;
- б) Mg(OH)2 + HNO3 →;
- в) Fe + H2O →;
- г) K3PO4 + AgNO3 →.
5. Для приготовления раствора объёмом 0,5 дм3 сульфата меди(II) c молярной концентрацией 0,01 моль/дм3 необходимо взвесить медный купорос массой:
- а) 0,8 г;
- б) 1,25 г;
- в) 1,6 г;
- г) 2,5 г.
Подготовьте сообщение. Оксиды и соли в ювелирном магазине.