§ 4. Структура i ўласцівасці бялкоў
Разнастайнасць і ўласцівасці бялкоў. У залежнасці ад саставу адрозніваюць простыя і складаныя бялкі. Малекулы простых бялкоў пабудаваны толькі з амінакіслотных астаткаў *(керацін, калаген, фібрын, альбуміны крыві і інш.)*. У састаў складаных бялкоў, акрамя таго, уваходзіць які-небудзь кампанент неамінакіслотнай прыроды *— так званая прастэтычная група. Больш дэталёвая інфармацыя пра складаныя бялкі прыведзена ў табліцы 4.1.*
*Табліца 4.1. Асноўныя групы складаных бялкоў
|
Назва |
Прастэтычная група |
Прыклады |
|
Металапратэіны |
Іон металу |
ДНК-палімераза (змяшчае Mg2+), |
|
Фосфапратэіны |
Фосфарная кіслата |
Казеін малака, вітэлін яечнага жаўтка |
|
Глікапратэіны |
Вуглявод |
Антыцелы (імунаглабуліны), муцын сліны |
|
Ліпапратэіны |
Ліпід |
Храмацін |
|
Нуклеапратэіны |
Нуклеінавая кіслата |
Тромбапластын, ліпапратэіны клетачных мембран |
|
Хромапратэіны |
Афарбаваны небялковы кампанент (пігмент) |
Гемаглабін, міяглабін* |
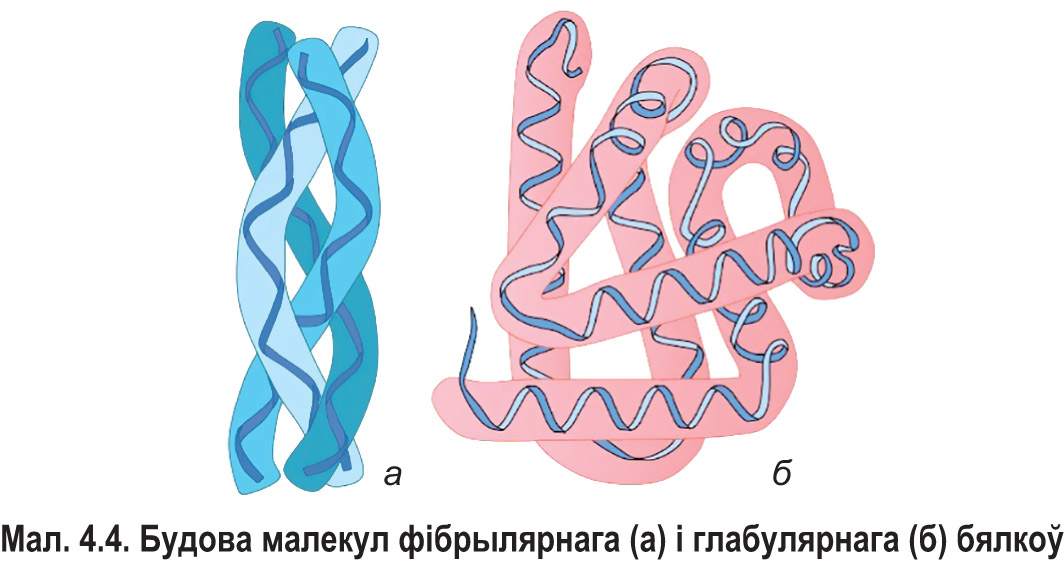 Па форме малекул вылучаюць дзве групы бялкоў — фібрылярныя і глабулярныя. Фібрылярнымі называюць бялкі, малекулы якіх маюць выцягнутую, ніткападобную форму (мал. 4.4). Гэта, напрыклад, калаген, керацін, міязін. Малекулы глабулярных бялкоў маюць акруглую форму. Да гэтай групы належаць альбуміны і глабуліны крыві, гемаглабін і інш.
Па форме малекул вылучаюць дзве групы бялкоў — фібрылярныя і глабулярныя. Фібрылярнымі называюць бялкі, малекулы якіх маюць выцягнутую, ніткападобную форму (мал. 4.4). Гэта, напрыклад, калаген, керацін, міязін. Малекулы глабулярных бялкоў маюць акруглую форму. Да гэтай групы належаць альбуміны і глабуліны крыві, гемаглабін і інш.
Многія бялкі добра раствараюцца ў вадзе, аднак сярод іх ёсць і нерастваральныя — керацін, фібрын і інш. Вядома, што глабулярныя бялкі ў асноўным з’яўляюцца водарастваральнымі, а фібрылярныя, як правіла, у вадзе не раствараюцца.
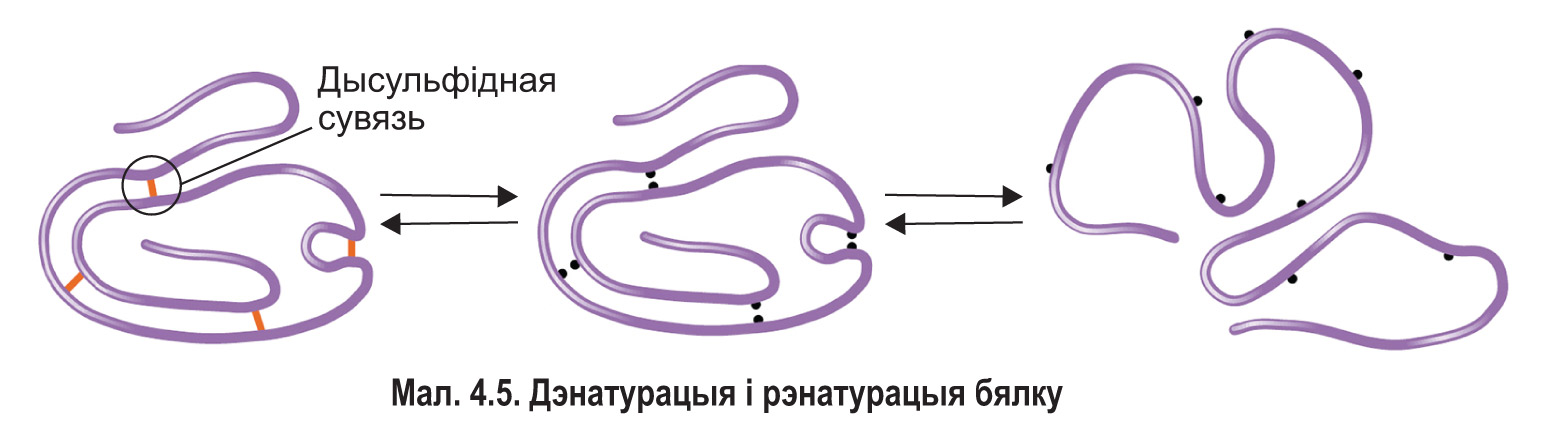
Бялкі адчувальныя да знешніх уздзеянняў: змяненне хімічнага саставу асяроддзя, тэмпературы і іншых фактараў выклікае змяненне іх структуры і ўласцівасцей. Дзеянне высокіх і нізкіх тэмператур, моцных кіслот і шчолачаў, іонаў цяжкіх металаў, ультрафіялетавага выпраменьвання, радыяцыі вядзе да разбурэння сувязей, якія стабілізуюць прасторавую канфігурацыю бялкоў. У выніку разрыву вадародных, іонных, дысульфідных і іншых сувязей бялок можа паслядоўна страціць сваю чацвярцічную, трацічную і нават другасную структуру. Працэс парушэння прыроднай структуры бялку пад уплывам знешніх фактараў без разбурэння яго першаснай структуры называецца дэнатурацыяй (мал. 4.5).
Прасторавая структура бялку вызначае яго фізіка-хімічныя ўласцівасці і біялагічныя функцыі. Таму дэнатурацыя прыводзіць не толькі да змянення памераў і формы малекул бялку, але і яго ўласцівасцей, напрыклад растваральнасці. Непалярныя гідрафобныя групы, якія размяшчаліся ўнутры малекулы, аказваюцца на яе паверхні, і бялок становіцца менш гідрафільным. Важна тое, што ў выніку дэнатурацыі бялкі губляюць здольнасць выконваць свае функцыі.
Ступень дэнатурацыі бялку залежыць ад сілы ўздзеяння на яго розных фактараў: чым больш інтэнсіўнае іх дзеянне, тым глыбей дэнатурацыя. У шэрагу выпадкаў яна становіцца незваротнай. Аднак калі фактар, які выклікаў дэнатурацыю, дзейнічаў недоўгачасова, то пасля спынення яго ўздзеяння бялок можа аднавіць сваю прыродную структуру, уласцівасці і функцыі. Такая з’ява называецца рэнатурацыяй. Разгорнуты поліпептыдны ланцуг здольны самаадвольна аднавіць другасную структуру, а затым укласціся ў трацічную. Гэта азначае, што прасторавая канфігурацыя бялку вызначаецца яго першаснай структурай, г. зн. паслядоўнасцю амінакіслотных астаткаў. Калі ж уздзеянне на бялок было занадта моцным і прывяло да разрыву пептыдных сувязей, вяртанне бялковай малекулы да зыходнай структуры становіцца немагчымым.
*Большасць бялкоў дэнатуруе пры награванні вышэй за 50—60 °С. Але, напрыклад, дэнатурацыя скарачальных бялкоў мышцаў пачынаецца ўжо пры 45—50 ° С, а яечны бялок дэнатуруе пры тэмпературы 60—70 ° С. Бялкі некаторых тэрмафільных бактэрый, што жывуць у гарачых крыніцах, могуць паўнавартасна функцыяніраваць пры тэмпературах вышэй за 90 ° С!
З'ява дэнатурацыі шырока выкарыстоўваецца ў медыцыне, біяхімічных даследаваннях, харчовай прамысловасці і іншых сферах дзейнасці чалавека.
Ужыванне такіх антысептыкаў, як спірт, хлорамін, фармалін і да т. п., заснавана на тым, што яны выклікаюць дэнатурацыю бялкоў і, з прычыны гэтага, гібель мікраарганізмаў. Тое ж самае адбываецца пад дзеяннем высокіх тэмператур пры стэрылізацыі медыцынскіх інструментаў і матэрыялаў. Ультрафіялетавае выпраменьванне выкарыстоўваецца ў якасці агента, які дэнатуруе, для дэзынфекцыі памяшканняў, прамысловага абеззаражвання вады і г. д.
Дэнатурацыю бялкоў можа выклікаць і далучэнне да іх іонаў цяжкіх металаў. Пры гэтым яны трывала звязваюцца з дэнатураваным бялком, які выпадае ў асадак. Таму пры харчовым атручэнні злучэннямі ртуці, свінцу, медзі пацярпеўшаму як мага хутчэй даюць выпіць малако ці раствор яечнага бялку для таго, каб абмежаваць далейшае ўсмоктванне таксічных рэчываў.
*Асаджэнне бялкоў пры дэнатурацыі таксама ўжываецца ў лабараторнай практыцы. Яно дазваляе выдаляць бялкі з розных вадкасцей біялагічнага паходжання (напрыклад, плазмы крыві, ліквару), што палягчае працэсы вылучэння і аналізу іншых рэчываў, якія ўваходзяць у састаў такіх вадкасцей. Акрамя таго, асаджэнне бялкоў выкарыстоўваецца для вызначэння іх колькаснага ўтрымання ў біялагічным матэрыяле.
Дэнатурацыя знаходзіць прымяненне ў харчовай прамысловасці, напрыклад, для атрымання тварагу, жэлаціну і інш. Цеплавая апрацоўка прадуктаў харчавання выкарыстоўваецца не толькі для знішчэння змешчаных у іх мікраарганізмаў. Бялкі, якія ўваходзяць у састаў харчовых прадуктаў, дэнатуруюць, з прычыны чаго яны лягчэй расшчапляюцца стрававальнымі ферментамі і лепш засвойваюцца арганізмам.*
*Радыкалы шэрага амінакіслот, што ўваходзяць у састаў бялковай малекулы, змяшчаюць асноўныя і кіслотныя функцыянальныя групы. Таму бялкі, як і амінакіслоты, з'яўляюцца амфатэрнымі злучэннямі. Амфатэрнасць надае бялкам буферныя ўласцівасці.
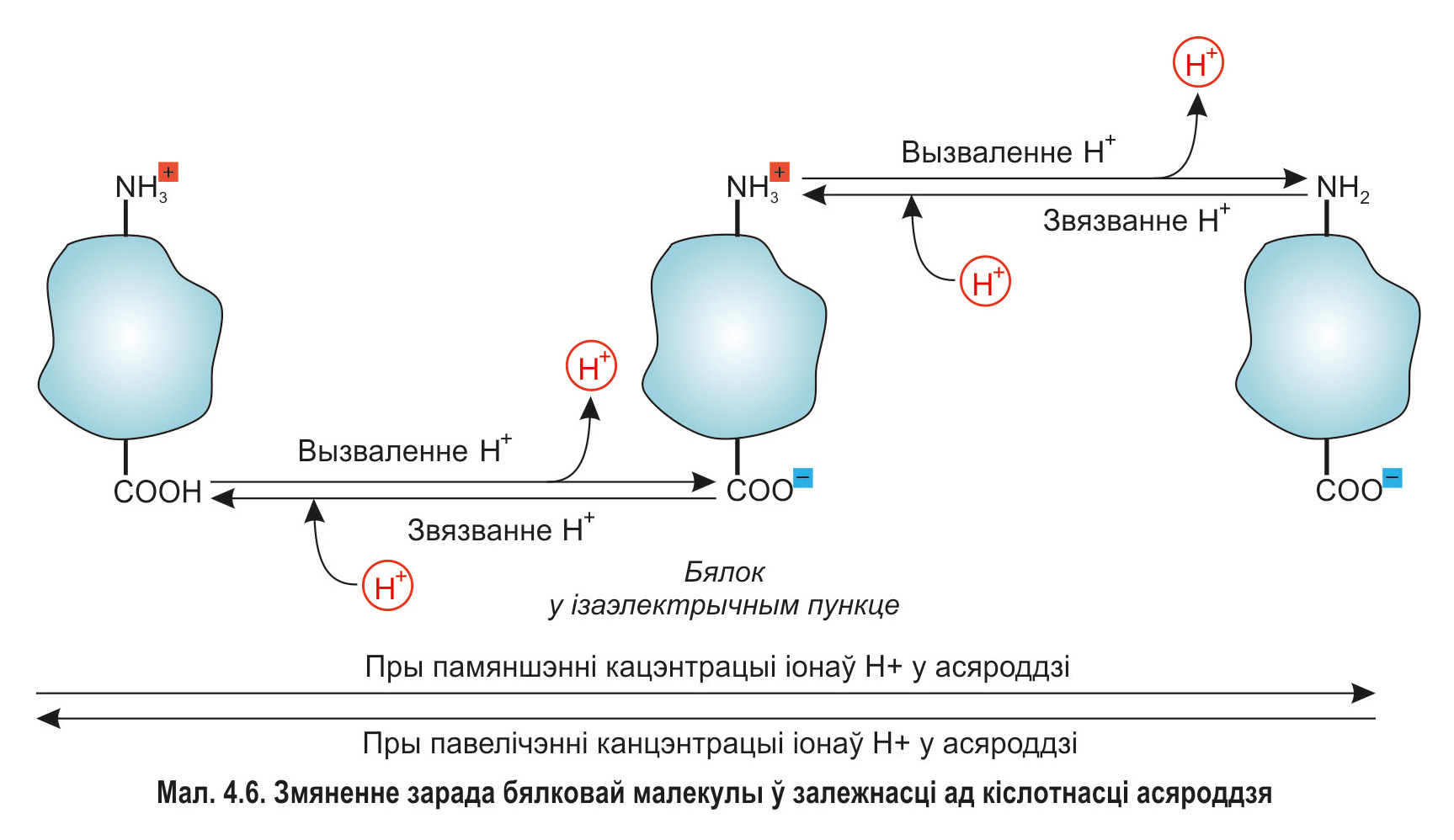
Так, пры павышэнні кіслотнасці (г. зн. пры павелічэнні канцэнтрацыі іонаў вадароду) зніжаецца дысацыяцыя карбаксільных груп, якія змяшчаюцца ў радыкалах кіслых амінакіслот. У той жа час амінагрупы асноўных амінакіслот злучаюць лішак іонаў H+. За кошт гэтага пры пэўнай велічыні pH малекула бялку набывае дадатны зарад (мал. 4.6).
Зніжэнне кіслотнасці асяроддзя ўзмацняе дысацыяцыю груп –СООН. Пры гэтым вызваляюцца дадатковыя іоны вадароду і зарад бялковай малекулы робіцца адмоўным. Такім чынам, бялкі здольныя ў пэўнай ступені падтрымліваць узровень рН-асяроддзя. Напрыклад, альбуміны і глабуліны ўдзельнічаюць у падтрыманні слабашчолачнай рэакцыі плазмы крыві (разам з іншымі буфернымі сістэмамі).*
*Пры пэўным значэнні pH колькасць дадатна і адмоўна зараджаных груп у малекуле бялку робіцца аднолькавай, і яго сумарны электрычны зарад аказваецца роўным нулю. Такое значэнне pH называюць ізаэлектрычным пунктам бялку (гл. мал. 4.6). Кожны бялок мае пэўнае значэнне ізаэлектрычнага пункта, якое вызначаецца амінакіслотным саставам. Ізаэлектрычныя пункты бялкоў, у саставе якіх пераважаюць астаткі кіслых амінакіслот, змяшчаюцца ў вобласці pH<7, а бялкоў, у якіх пераважаюць асноўныя амінакіслоты, — у дыяпазоне pH>7.
У большасці бялкоў значэнне ізаэлектрычнага пункта знаходзіцца ў межах 5,5—7,0. Але, напрыклад, для пепсіну (ферменту страўнікавага соку) велічыня ізаэлектрычнага пункта роўна 1, а для сальміну (бялок, што змяшчаецца ў малацэ сёмгі) — амаль 12.
Чым больш значэнне рН асяроддзя адрозніваецца ад ізаэлектрычнага пункта, тым большы зарад мае бялок. З прычыны гэтага паміж бялковымі малекуламі існуе электрастатычнае адштурхванне, якое перашкаджае іх зліпанню (агрэгацыі). У ізаэлектрычным пункце сілы адштурхвання мінімальныя. Таму бялкі найменш устойлівыя ў растворы, іх малекулы лёгка зліпаюцца і выпадаюць у асадак.*