§ 4. Структура i ўласцівасці бялкоў
Бялкі *(пратэіны)* — гэта поліпептыды, у састаў малекул якіх уваходзіць мноства астаткаў амінакіслот (да некалькіх тысяч). *Бялкі — нерэгулярныя біяпалімеры.* Бялкі адрозніваюцца колькасцю амінакіслотных звёнаў, іх саставам і паслядоўнасцю размяшчэння. Пры гэтым кожны бялок мае асаблівы, уласцівы толькі яму парадак чаргавання амінакіслот.
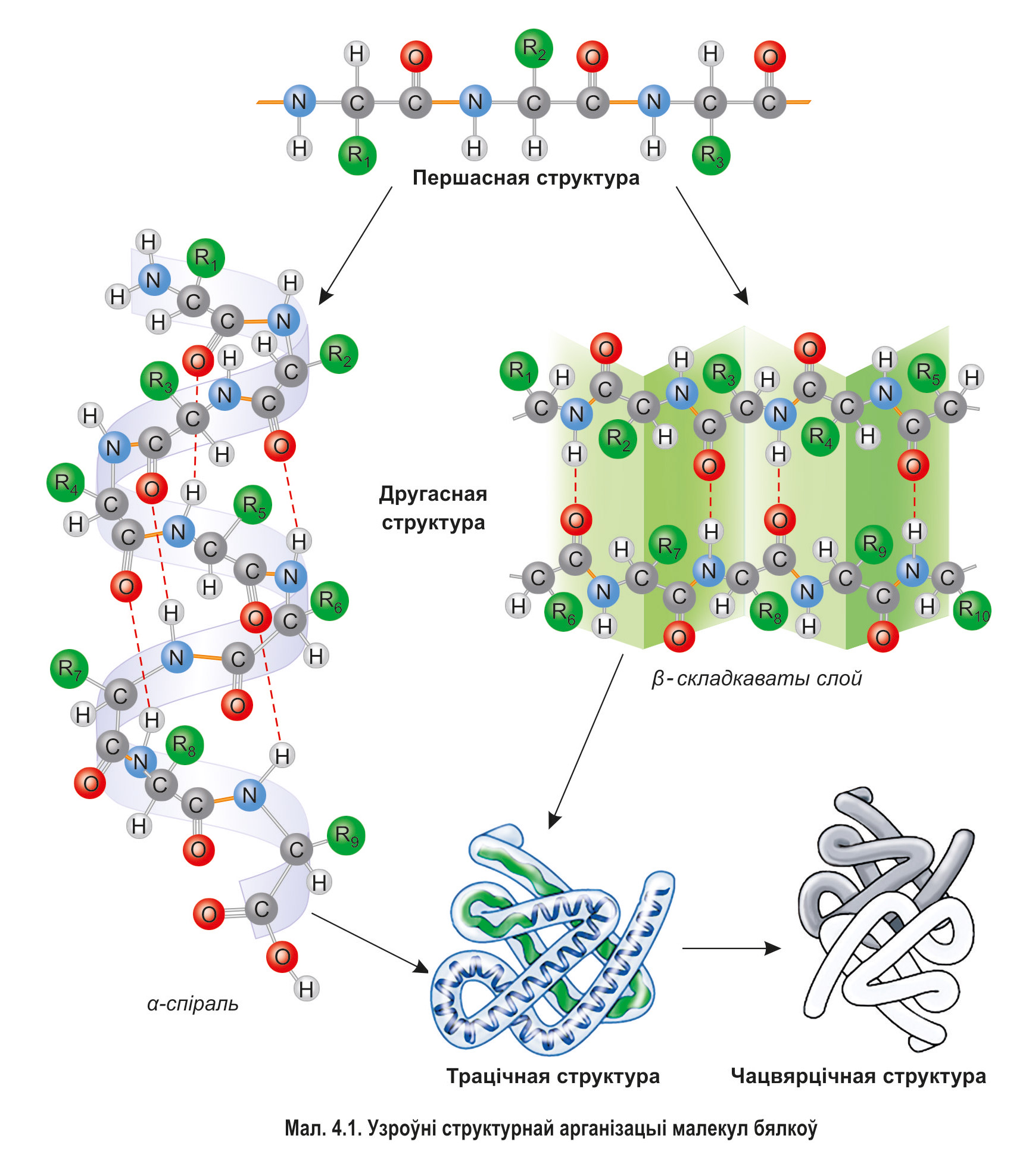
Узроўні структурнай арганізацыі бялковых малекул. Для таго каб бялок мог выконваць сваю біялагічную функцыю, яго малекула павінна мець пэўную прасторавую канфігурацыю. Адрозніваюць чатыры асноўныя ўзроўні арганізацыі бялковых малекул — першасную, другасную, трацічную і чацвярцічную структуры (мал. 4.1).
Першасная структура бялку — гэта строга вызначаная паслядоўнасць амінакіслотных астаткаў у лінейным поліпептыдным ланцугу. Кожны бялок валодае ўнікальнай першаснай структурай. Яе існаванне абумоўлена наяўнасцю трывалых пептыдных сувязей паміж астаткамі амінакіслот. Усе наступныя, больш складаныя структуры фарміруюцца на аснове першаснай. Таму змяненне першаснай структуры (напрыклад, замена адных амінакіслотных астаткаў на другія) прыводзіць да змянення формы малекулы, уласцівасцей і функцый бялку.
Другасная структура бялку фарміруецца за кошт утварэння шматлікіх вадародных сувязей паміж атамамі вадароду NH-груп і атамамі кіслароду CO-груп розных амінакіслотных астаткаў. Нягледзячы на тое што гэтыя сувязі слабейшыя за кавалентныя, іх колькасць забяспечвае стабільнасць другаснай структуры.
Часцей за ўсё вадародныя сувязі ўзнікаюць унутры аднаго поліпептыднага ланцуга паміж блізка размешчанымі астаткамі амінакіслот, што прыводзіць да закручвання гэтага ланцуга ў так званую α-спіраль.
Часам вадародныя сувязі ўзнікаюць паміж адносна аддаленымі адзін ад аднаго ўчасткамі поліпептыднага ланцуга (або некалькіх розных ланцугоў). *Дадзеныя ўчасткі могуць размяшчацца паралельна (калі поліпептыдныя ланцугі ідуць у адным напрамку, напрыклад, ад N-канца да C-канца) або антыпаралельна (калі ланцугі маюць процілеглы напрамак: адзін ідзе ад N-канца да С-канца, а суседні — наадварот).* Пры гэтым дадзеныя ўчасткі размяшчаюцца паралельна адзін аднаму і складаюцца накшталт гармоніка. Такі тып другаснай структуры атрымаў назву β-складкаваты слой (см. мал. 4.1).
Некаторыя бялкі маюць другасную структуру, прадстаўленую толькі α-спіраллю ці β-складкаватым слоем. Напрыклад, цалкам α-спіральную канфігурацыю мае керацін — асноўны бялок валасоў і пазногцяў чалавека, а другасная структура фібраіну (бялку натуральнага шоўку) прадстаўлена выключна β-складкаватым слоем. У структуры многіх бялкоў адны ўчасткі маюць выгляд α-спіралі, а другія — β-складкаватага слоя.
*α- спіральныя і β-структурныя ўчасткі бялковай малекулы могуць узаемадзейнічаць адзін з адным і паміж сабой, утвараючы ўпарадкаваныя структуры (ансамблі). Напрыклад, α-спіральныя фрагменты могуць аб’ядноўвацца ў двайныя ці трайныя спіралі. На аснове β-участкаў часта ўтвараюцца структуры, якія маюць выгляд шпілек, арак, зігзагаў і інш. Участкі, якія маюць α- і β- будову, могуць фарміраваць ансамблі саставу αβ, βαβ, βαβαβ і да т. п. Гэтыя прасторавыя канфігурацыі ўяўляюць сабой так званую звышдругасную структуру бялку.
Ансамблі звышдругаснай структуры з'яўляюцца асновай для фарміравання ў малекулах бялкоў даменаў. Гэта структурна і функцыянальна адмежаваныя вобласці, злучаныя адна з адной кароткімі фрагментамі поліпептыднага ланцуга — шарнірнымі ўчасткамі.
Напрыклад, малекулы мембранных бялкоў-рэцэптараў часцей за ўсё складаюцца з трох даменаў. Надмембранны дамен забяспечвае прыём знешніх сігналаў, унутрымембранны замацоўвае бялок у мембране, падмембранны ажыццяўляе перадачу сігналу ўнутр клеткі. Іншым прыкладам можа служыць сываратачны альбумін — бялок плазмы крыві, здольны звязвацца з вышэйшымі карбонавымі кіслотамі, білірубінам, некаторымі таксінамі і іншымі злучэннямі і дастаўляць іх у тыя ці іншыя органы. Малекула гэтага бялку змяшчае тры дамены, кожны з якіх адказвае за выбіральнае злучэнне з пэўнымі рэчывамі.*
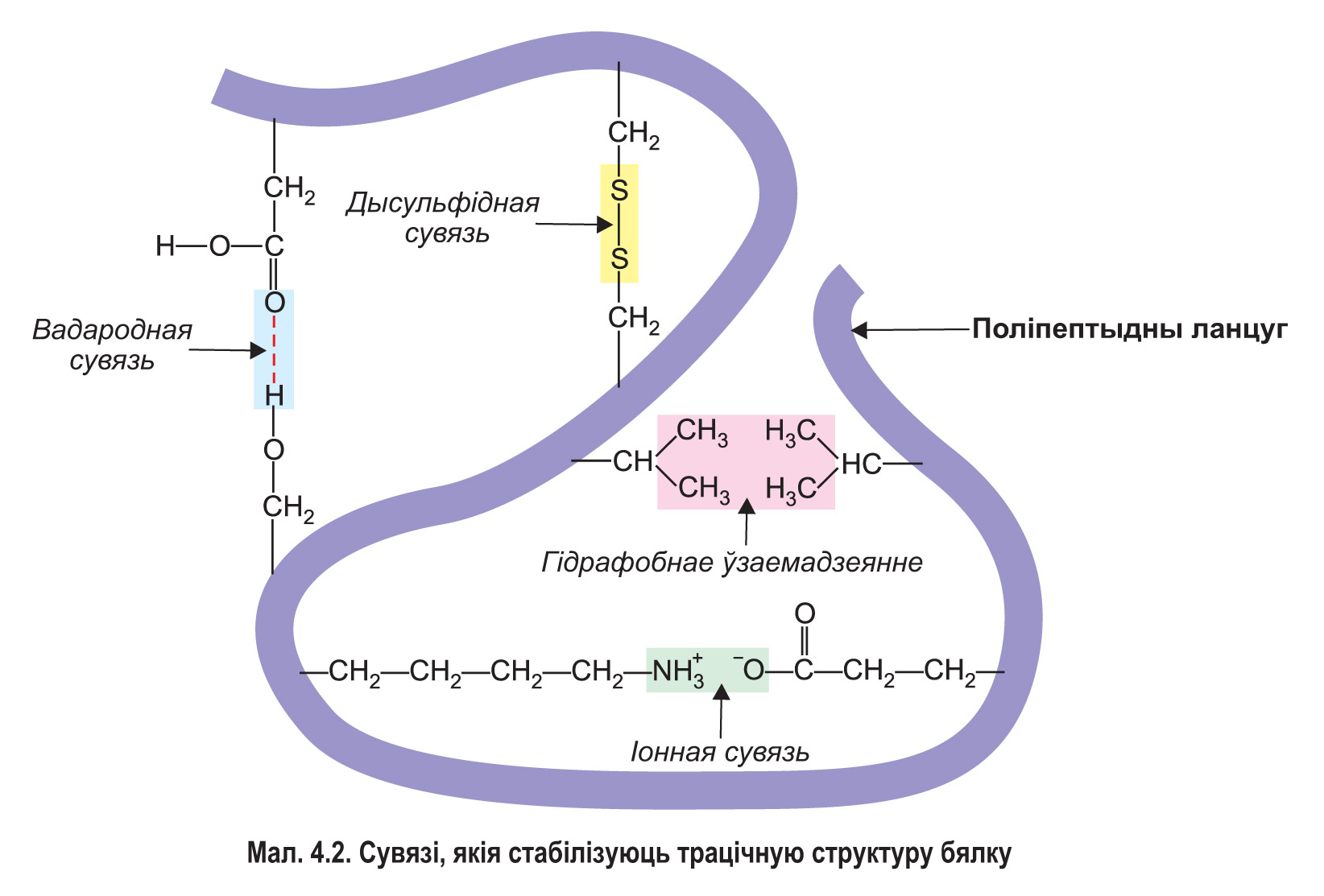
Фарміраванне трацічнай структуры забяспечваюць вадародныя, іонныя і іншыя сувязі, якія ўзнікаюць паміж рознымі групамі атамаў бялковай малекулы. У водным асяроддзі малекула бялку асаблівым чынам укладваецца ў прасторы, набываючы кампактную форму. Пры гэтым гідрафобныя амінакіслотныя радыкалы апускаюцца ўнутр бялковай малекулы і прыцягваюцца адзін да аднаго — такое прыцягненне называецца гідрафобным узаемадзеяннем. Гідрафільныя ўчасткі поліпептыду, наадварот, размяшчаюцца на паверхні і ўзаемадзейнічаюць з малекуламі вады. У многіх бялкоў ва ўтварэнні трацічнай структуры ўдзельнічаюць кавалентныя дысульфідныя сувязі (S—S сувязі), якія ўзнікаюць паміж астаткамі амінакіслаты цыстэіну (мал. 4.2.). Трацічная структура кожнага бялку мае асаблівую, непаўторную прасторавую канфігурацыю.
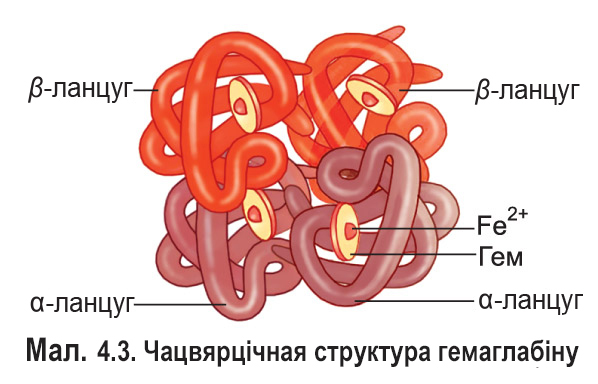
Многія бялкі здольныя выконваць свае біялагічныя функцыі, валодаючы трацічнай структурай. Але некаторым бялкам для гэтага неабходна аб’яднанне ў адзіны комплекс дзвюх ці больш малекул, якія маюць трацічную структуру. Так узнікае чацвярцічная структура бялку. Малекулы, якія ўваходзяць у яе састаў, *(іх называюць субадзінкамі або пратамерамі)*, могуць быць аднолькавымі ці рознымі. Яны ўтрымліваюцца разам дзякуючы розным відам некавалентных сувязей — вадародным, іонным, гідрафобным узаемадзеянням і інш. У некаторых бялках, напрыклад імунаглабулінах, да мноства такіх сувязей дабаўляюцца некалькі кавалентных дысульфідных. Прыкладам бялку, які мае чацвярцічную структуру, можа служыць гемаглабін (мал. 4.3).
У састаў гемаглабіну чалавека ўваходзяць чатыры поліпептыдныя ланцугі двух розных тыпаў: два α-ланцугі (змяшчаюць па 141 амінакіслотным астатку) і два β-ланцугі (па 146 астаткаў). Кожны ланцуг фарміруе спецыяльную гідрафобную кішэнь, у якой размяшчаецца кампанент небялковай прыроды — гем. Цэнтральную частку гема займае іон Fe2+.