§ 31. Квантовые постулаты Бора
|
Долгое время атом считался мельчайшей неделимой частицей вещества, являющейся носителем его физических свойств. Однако открытие радиоактивности и первой элементарный частицы (электрона) поставило под сомнение факт его неделимости. Почему атом устойчив? Какие физические процессы происходят в атомах? Как атом излучает свет? |
Для преодоления противоречий, возникающих при описании строения атома на основе законов классической механики и электродинамики с экспериментальными данными, датский физик Нильс Бор в 1913 г. в работе «О строении атомов и молекул» предложил квантовую модель атома, основанную на двух постулатах.

В современном виде они формулируются следующим образом:
I постулат Бора (постулат стационарных состояний): атом может находиться в особых стационарных (квантовых) состояниях, каждому из которых соответствует определенная энергия. В стационарном состоянии атом не излучает.
Стационарные состояния можно пронумеровать, присвоив им порядковые номера n = 1,2,3,… , причем каждому состоянию соответствует определенное дискретное значение энергии En.
Согласно модели Бора стационарным состояниям атома соответствуют определенные (разрешенные) орбиты, по которым электроны движутся вокруг ядра. Бор для простоты полагал, что эти орбиты представляют собой окружности, хотя в общем случае орбиты могут иметь форму эллипса, причем ядро располагается в одном из его фокусов (рис. 194)
Первый постулат противоречит как законам классической механики (энергия движущихся электронов может быть любой), так и законам классической электродинамики (ускоренно движущиеся электроны всегда излучают электромагнитные волны).
II постулат Бора (правило частот): атом может переходить из одного стационарного состояния в другое. При этом переходе может испускаться или поглощаться квант электромагнитной энергии, частота которого определяется разностью энергий атома в данных состояниях:
|
|
(1) |
где — частота поглощенного или испущенного кванта излучения, Ek, En — энергия атома в k-ом и n-ом стационарном состоянии, h — постоянная Планка.
Если то при переходе происходит излучение энергии, если
то — ее поглощение.
Состояние атома, которому соответствует наименьшая энергия, называется основным, а состояния, которым соответствуют большие значения энергии, — возбужденными. В основном энергетическом состоянии атом может находиться неограниченно долго, а в остальных стационарных состояниях . Это так называемое время жизни атома в возбужденном состоянии.
Как следует из II постулата Бора, частота излучения атома не связана с частотой вращения электрона по орбите, она определяется разностью значений энергии атома Ek и En в начальном и конечном состояниях. Переход атома из одного стационарного состояния в другое сопровождается электромагнитным излучением с длиной волны:
| (2) |
Таким образом, первый постулат Бора позволил объяснить дискретность значений энергии атома, а первый и второй постулаты — линейчатую структуру атомных спектров.
Бор предложил также количественное условие квантования для нахождения радиусов стационарных (разрешенных) круговых орбит электронов:
|
|
(3) |
где n = 1,2,3,…, — номер орбиты, me — масса электрона, vn — модуль скорости электрона на n-й орбите, r — радиус n-й орбиты, h — постоянная Планка.
Таким образом, постулаты Бора основывались на трех экспериментальных предпосылках — результатах исследования атомных спектров, квантовой теории излучения, развитой Планком и Эйнштейном, и ядерной (планетарной) модели атома Резерфорда.
Исходя из постулатов Бора и условия квантования орбит, можно объяснить структуру энергетических уровней простейшего атома — атома водорода, состоящего из ядра (протона) и одного электрона, вращающегося вокруг него.
На основании второго закона Ньютона и закона Кулона, а также условия квантования орбит (3) Бор смог определить радиусы орбит электронов, а также энергии стационарных состояний. Радиус первой (ближайшей к атомному ядру) орбиты электрона (n = 1) определяет размер атома водорода в основном состоянии. Он равен
Из второго закона Ньютона следует, что при движении электрона по круговой орбите радиусом r вокруг ядра с линейной скоростью , сила Кулона
сообщает электрону центростремительное ускорение:
| (3-1) |
где e - модуль заряда электрона.
Откуда:
| (3-2) |
Из условия квантования орбит (3) находим модуль скорости на орбите с номером n:
| (3-3) |
Подставляем выражение (3-3) в соотношение (3-2) и находим радиус стационарной орбиты электрона с номером n:
| (3-4) |
Как видно из формулы (3-4), радиус орбиты возрастает пропорционально .
Модуль скорости электрона на орбите находим, подставляя выражение (3-4) в формулу (3-3):
| (3-5) |
Так как радиус r орбиты может принимать только дискретные (квантованные) значения (3-3), то и энергия атома в различных стационарных состояниях может также принимать только дискретные значения Eп. Энергия атома водорода определяется только номером орбиты .
Энергия электрона в атоме водорода равна сумме его кинетической энергии Eк при движении по круговой орбите и потенциальной энергии Eп в электростатическом поле ядра. Поскольку взаимодействуют частицы, имеющие заряды противоположных знаков (заряд ядра , заряд электрона
), то между ними действует сила кулоновского притяжения, и потенциальная энергия их взаимодействия отрицательна:
| (3-6) |
Энергия электрона в атоме совпадает с полной энергией атома — системы, состоящей из атомного ядра и электрона:
| (3-7) |
Подставив в формулу (3-7) выражение для модуля скорости (3-5) и радиуса n-й орбиты (3-4) для значений энергетических уровней атома
, получаем:
Бор получил выражение для энергии атома водорода:
| (4) |
Поэтому энергия атома водорода (4) фактически определяется только номером орбиты n электрона, так как величина является постоянной, вследствие того что выражается через фундаментальные постоянные (заряд электрона e, массу электрона
, постоянную Планка h, электрическая постоянная
).
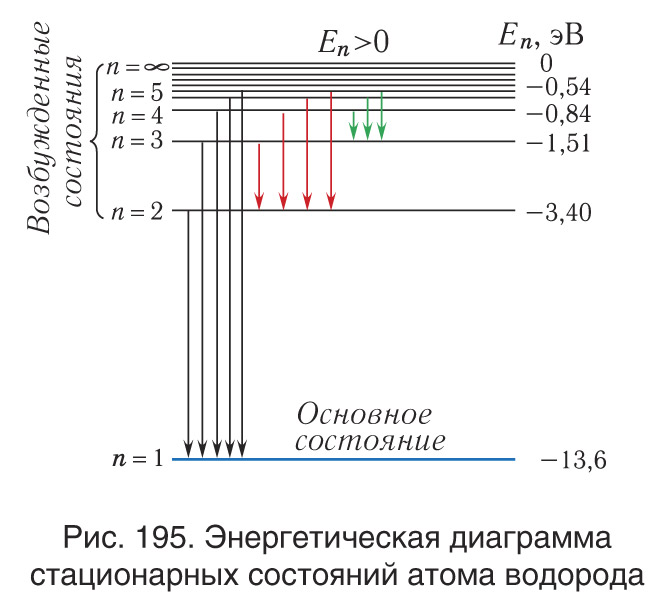
Согласно формуле (4) энергия атома водорода в основном состоянии (n = 1) получается равной = −13,6 эВ, а его энергия в ионизированном состоянии, когда электрон бесконечно далек от ядра (
) равной
. Во втором состоянии (n = 2) энергия
в третьем (n = 3) —
и т. д. Энергию атома водорода в любом состоянии можно рассчитать по формуле:
|
|
(5) |
Так как энергия атома водорода может принимать только дискретный набор значений, то говорят, что она квантована.
Для наглядного представления стационарных энергетических состояний атома используется энергетическая диаграмма (рис. 195). Графически возможные значения энергии атома изображают в виде схемы уровней энергии (энергетических уровней) — горизонтальных прямых, проведенных на расстояниях в определенном масштабе, соответствующем разностям разрешенных значений энергии. Переходы атома из одного состояния в другое изображаются на диаграмме вертикальными линиями между соответствующими уровнями. Направление перехода обозначается стрелками.
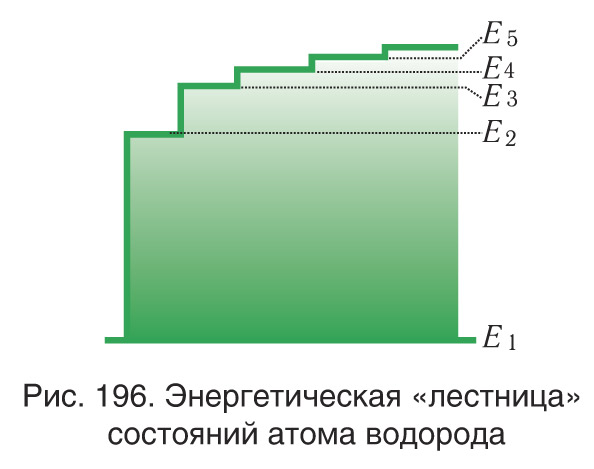
Энергетическую диаграмму можно считать своеобразной «лестницей» с «нижней площадкой» (основным состоянием) и поднимающимися вверх «ступенями» (возбужденными состояниями). Формула для энергетических уровней энергии атома показывает важную закономерность: чем выше поднимается над основным (первым) уровнем энергетическая «лестница», тем менее «крутыми» становятся ее ступени (на рисунке 196 это хорошо видно при
).
Следовательно, чем дальше электрон от ядра (), тем на меньшую величину отличаются соседние уровни энергии, т.е. густота энергетических уровней растет. Квантовые скачки при этом уменьшаются, вследствие чего переходы между стационарными состояниями атома все больше и больше становятся «похожими» на непрерывное изменение энергии. Энергетическая «лестница» постепенно превращается в пологий «плавный подъем» (см. рис. 196), т.е. энергия становится почти непрерывно меняющейся величиной, как это и было в классической теории.
Процесс удаления электрона из атома называется ионизацией. Для удаления электрона из атома водорода, находящегося в основном состоянии, атому необходимо сообщить энергию Eи = E∞ - E1 = 13,6 эВ
Поэтому эту энергию Eи называют энергией ионизации атома водорода. Следовательно, энергия ионизации равна работе, которую необходимо совершить внешним силам для удаления электрона на «бесконечное» расстояние из атома, находящегося в основном состоянии. Здесь под «бесконечностью» понимается такое расстояние, при котором взаимодействием электрона и ядра можно пренебречь.
Отметим, что выше уровня (при
) электрон является свободным и может иметь любую энергию.
Энергия
называется энергией связи электрона в атоме водорода.
Энергия связи определяется электромагнитным взаимодействием частиц и является отрицательной величиной, вследствие того, что при образовании атома энергия выделяется. Абсолютное значение энергии связи характеризует прочность связи и устойчивость атома.
Энергия связи по абсолютной величине равна энергии ионизации электрона в атоме:
В соответствии с представлениями квантовой механики свободное движение электрона, оторванного от атома, подобно распространению бегущей волны в неограниченном пространстве. Для нее возможны любые значения длин волн. Следовательно, энергия свободного электрона не квантуется, и частота излучения меняется плавно (спектр излучения непрерывный). Вследствие этого линия, обозначенная на энергетической диаграмме n = ∞ , соответствует коротковолновой границе линейчатой структуры излучения (поглощения) атома. К ней примыкает непрерывный спектр излучения электрона
Ионизация сложных атомов может быть однократной (атом теряет один электрон), двукратной (два электрона) и т. д.
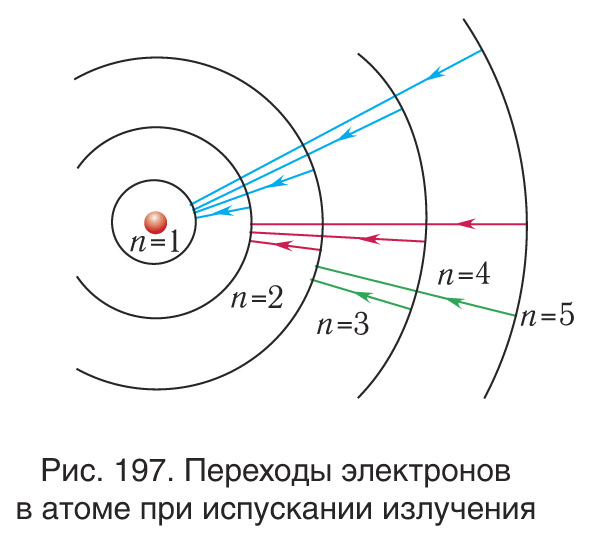
Поскольку при возбуждении атома радиус орбиты электрона возрастает, то испускание излучения атомом происходит при переходах электронов в атоме с внешних орбит на внутренние (рис. 197)
Модель атома Бора позволяет описать не только атом водорода, но и ионизированные атомы (ионы) других элементов, вокруг ядер которых, как и в атоме водорода, движется только один электрон. Такие ионы называются водородоподобными. Примерами таких ионов являются однократно ионизированный атом гелия (), двукратно ионизированный атом лития (
) и т. д.
Необходимо отметить, что энергия атома может изменяться не только при испускании или поглощении энергии, но и при столкновении атомов. При неупругом столкновении изменяется внутренняя энергия сталкивающихся атомов, и электроны в них переходят на другие уровни энергии.
Таким образом, с помощью модели атома Бора удалось:
Во-первых, вычислить энергию ионизации атома водорода, хорошо согласующуюся с экспериментом. Как теория, так и эксперимент дали значение
Во-вторых, значительно продвинуться в объяснении закономерностей периодической системы химических элементов Менделеева. Согласно модели атома Бора электроны движутся по определенным орбитам, образующим различные группы — электронные оболочки. Структура электронных оболочек определяет химические свойства элементов, которые периодически повторяются по мере заполнения оболочек электронами. Это позволило «предсказывать» свойства неизвестных элементов; так, например, был открыт элемент с порядковым номером Z = 72 — гафний, по своим свойствам аналогичный цирконию (Z = 40).
Модель атома Бора объяснила основные закономерности спектра атома водорода, хотя частично сохранила классический характер, поскольку в ней предполагалось, что электроны движутся по орбитам вокруг ядра. Однако на основе данной модели не удалось построить теорию более сложных атомов, например объяснить спектр излучения следующего за водородом атома гелия, который содержит всего два электрона. Соответственно, не могло быть и речи об объяснении на основании данной модели строения молекул, так как в них картина движения и взаимодействия электронов и атомных ядер намного сложнее, чем в атомах.
Теория атома Бора явилась важнейшим этапом на пути создания последовательной теории микроскопических явлений — квантовой
механики.
Планеты Солнечной системы также движутся по эллипсам, в одном из фокусов которых находится Солнце. Это обстоятельство делает аналогию между ядерной моделью атома (см. рис. 194) и Солнечной системой еще более тесной.
Исследования Бора фактически положили начало новому этапу развития спектроскопии, которая из эмпирической науки превратилась в эффективный метод изучения атомной структуры. Спустя полвека по этому поводу Бор скажет: «Я увидел путь рождения спектров!».
| В |
 |