§ 7. Будова і ўласцівасці цвёрдых цел
Тыпы крышталёў. У залежнасці ад віду часціц, якія ўтвараюць крышталь, і ад характару сіл узаемадзеяння паміж імі адрозніваюць чатыры асноўныя тыпы крышталёў.
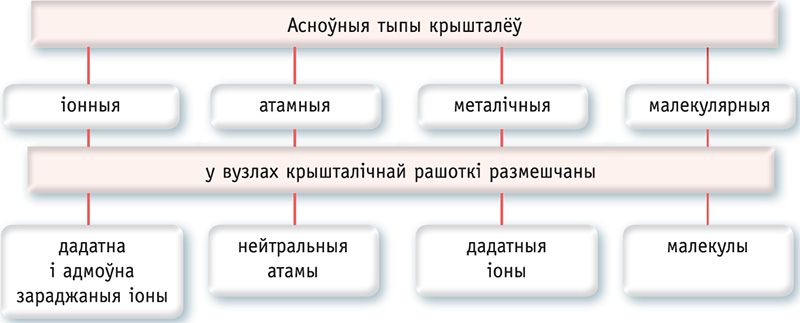
Тыповым прыкладам іоннага крышталя з’яўляецца крыш- а таль хларыду натрыю NaCl (мал. 44, а, б). Крышталі з іоннай рашоткай тугаплаўкія і маюць высокую цвёрдасць.
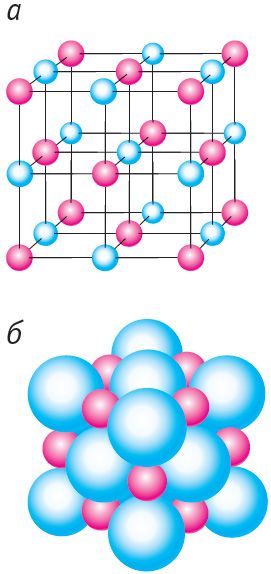
Прыклады атамных крышталёў — алмаз і графіт. Гэтыя крышталі тоесныя па хімічнай прыродзе (яны складаюцца з атамаў вугляроду), але адрозніваюцца па сваёй будове (мал. 45). У крышталічнай рашотцы алмазу кожны атам вугляроду знаходзіцца ў цэнтры тэтраэдра, вяршынямі якога з’яўляюцца чатыры найбліжэйшыя атамы, і трывала звязаны з гэтымі атамамі праз аб’яднанне валентных электронаў (мал. 45, а). Менавіта такой моцнай сувяззю і абумоўлена ўнікальная цвёрдасць алмазу. Крышталічная рашотка графіту мае слаістую структуру (мал. 45, б). Атамныя слаі графіту слаба звязаны адзін з адным, бо адлегласць паміж імі ў некалькі разоў большая, чым адлегласць паміж суседнімі атамамі ў адным слоі. Гэтым абумоўлена тое, што слаі могуць лёгка аддзяляцца адзін ад аднаго, чым і тлумачыцца мяккасць і крохкасць графіту.
Прыкладамі крышталёў з металічнай крышталічнай рашоткай з’яўляюцца палоній Po (гл. мал. 42, а), жалеза Fe (гл. мал. 42, б), серабро Ag (гл. мал. 42, в), магній Мg (гл. мал. 42, г).
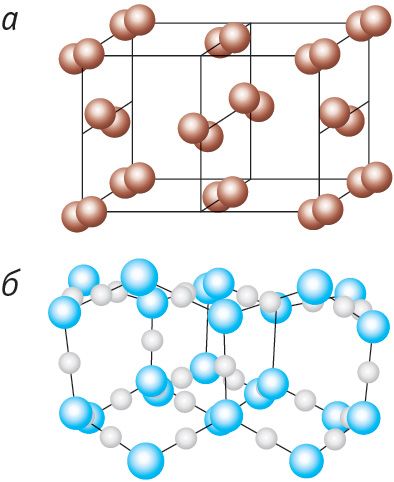
Малекулярныя крышталі ўтвараюць большасць простых рэчываў неметалаў у цвёрдым стане, напрыклад ёд I2 (мал. 46, а), вадарод H2, кісларод О2, і іх злучэнні адзін з адным (лёд H2О) (мал. 46, б), а таксама практычна ўсе цвёрдыя арганічныя рэчывы.