§ 7. Будова і ўласцівасці цвёрдых цел
| Сайт: | Профильное обучение |
| Курс: | Фізіка. 10 клас |
| Книга: | § 7. Будова і ўласцівасці цвёрдых цел |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 6 Июль 2025, 05:54 |
У паўсядзённым жыцці мы лічым цвёрдым любое цела, якое захоўвае форму і аб’ём пры адсутнасці знешніх уздзеянняў, напрыклад целы, вырабленыя з металаў, пластмасы, лёду, шкла. Цвёрдыя целы падзяляюць на дзве групы, якія адрозніваюцца па сваіх уласцівасцях: крышталічныя і аморфныя. У чым адрозненне паміж крышталічнымі цвёрдымі целамі і аморфнымі?
Крышталі. Да крышталічных цел адносяць мінералы, напрыклад павараную соль, медны купарвас, кварц, галын (мал. 40), горны хрусталь і металы ў цвёрдым стане.

Крышталі — цвёрдыя целы, атамы, іоны або малекулы якіх выконваюць цеплавыя ваганні каля пэўных, упарадкаваных у прасторы становішчаў раўнавагі.
Упарадкаванае размяшчэнне часціц цвёрдага крышталічнага цела абумоўлівае яго правільную геаметрычную форму, у выніку чаго паверхня крышталя ўтворана плоскімі гранямі (мал. 41).

Часціцы крышталя ўтрымліваюцца на пэўнай усярэдненай адлегласці адна ад адной (∼ 0,1 нм) сіламі міжатамнага і міжмалекулярнага ўзаемадзеянняў. Нягледзячы на цеплавыя ваганні, яны ўтвараюць упарадкаваную прасторавую структуру. Геаметрычнай выявай гэтай структуры з’яўляецца крышталічная рашотка. Вузлы крышталічнай рашоткі — гэта становішчы ўстойлівай раўнавагі, адносна якіх вагаюцца часціцы (іоны, атамы або малекулы), што ўтвараюць крышталь.
Асновай будовы крышталя з’яўляецца так званая элементарная крышталічная ячэйка — шматграннік найменшых памераў, паслядоўным пераносам без змены арыентацыі якога разам з часціцамі, што знаходзяцца ўнутры гэтага шматгранніка, можна пабудаваць увесь крышталь.
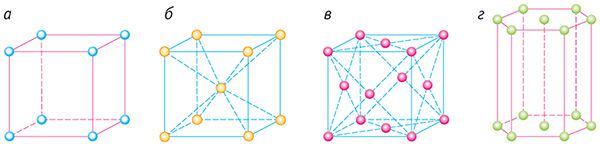
На малюнку 42 паказаны самыя простыя элементарныя ячэйкі: кубічныя (а — прымітыўная, б — аб’ёмна-цэнтраваная, в — гранецэнтраваная) і гексаганальная прызма (г).
У крышталічных целах упарадкаванае размяшчэнне часціц паўтараецца ва ўсім аб’ёме крышталя, таму гавораць, што ў крышталі існуе далёкі парадак у размяшчэнні часціц.
Цікава ведаць

Каб зразумець, чаму ў крышталічных целах існуе ўпарадкаванае размяшчэнне часціц, правядзём дослед. Насыплем на ўвагнутае шкло аднолькавыя маленькія шарыкі (мал. 43, а) і злёгку страсянём іх некалькі разоў. Можна ўбачыць, што шарыкі размесцяцца на шкле ў строгім парадку (мал. 43, б). Шарыкі знаходзяцца ў самым нізкім з магчымых становішчаў, што адпавядае мінімуму іх патэнцыяльнай энергіі ў гравітацыйным полі Зямлі.
Крышталічная структура таксама звязана з мінімумам патэнцыяльнай энергіі, гэта значыць, што пры ўтварэнні крышталёў часціцы самаадвольна размяшчаюцца так, каб патэнцыяльная энергія іх узаемадзеяння была мінімальная.
Тыпы крышталёў. У залежнасці ад віду часціц, якія ўтвараюць крышталь, і ад характару сіл узаемадзеяння паміж імі адрозніваюць чатыры асноўныя тыпы крышталёў.
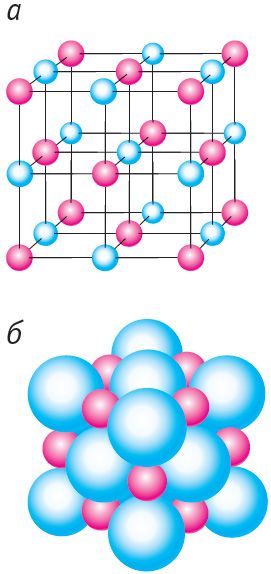
Тыповым прыкладам іоннага крышталя з’яўляецца крыш- а таль хларыду натрыю NaCl (мал. 44, а, б). Крышталі з іоннай рашоткай тугаплаўкія і маюць высокую цвёрдасць.
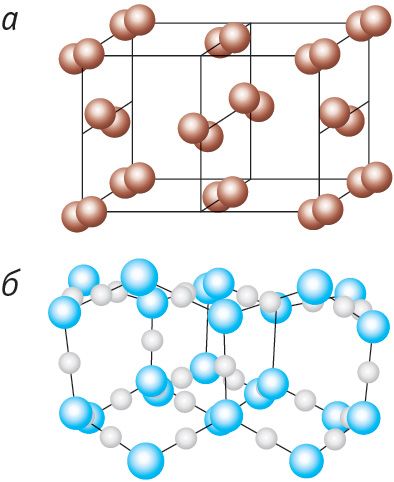
Прыклады атамных крышталёў — алмаз і графіт. Гэтыя крышталі тоесныя па хімічнай прыродзе (яны складаюцца з атамаў вугляроду), але адрозніваюцца па сваёй будове (мал. 45). У крышталічнай рашотцы алмазу кожны атам вугляроду знаходзіцца ў цэнтры тэтраэдра, вяршынямі якога з’яўляюцца чатыры найбліжэйшыя атамы, і трывала звязаны з гэтымі атамамі праз аб’яднанне валентных электронаў (мал. 45, а). Менавіта такой моцнай сувяззю і абумоўлена ўнікальная цвёрдасць алмазу. Крышталічная рашотка графіту мае слаістую структуру (мал. 45, б). Атамныя слаі графіту слаба звязаны адзін з адным, бо адлегласць паміж імі ў некалькі разоў большая, чым адлегласць паміж суседнімі атамамі ў адным слоі. Гэтым абумоўлена тое, што слаі могуць лёгка аддзяляцца адзін ад аднаго, чым і тлумачыцца мяккасць і крохкасць графіту.
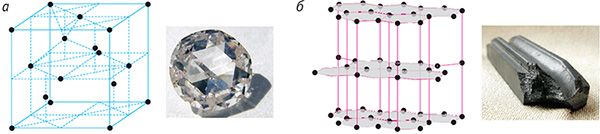
Прыкладамі крышталёў з металічнай крышталічнай рашоткай з’яўляюцца палоній Po (гл. мал. 42, а), жалеза Fe (гл. мал. 42, б), серабро Ag (гл. мал. 42, в), магній Мg (гл. мал. 42, г).
Малекулярныя крышталі ўтвараюць большасць простых рэчываў неметалаў у цвёрдым стане, напрыклад ёд I2 (мал. 46, а), вадарод H2, кісларод О2, і іх злучэнні адзін з адным (лёд H2О) (мал. 46, б), а таксама практычна ўсе цвёрдыя арганічныя рэчывы.
Монакрышталі і полікрышталі. Існуюць адзінкавыя крышталі, якія называюць монакрышталямі. Яны могуць мець даволі значныя памеры. Сустракаюцца крышталі горнага хрусталю, памеры якіх сувымерныя з ростам чалавека.
Монакрышталі — цвёрдыя целы, якія маюць ва ўсім аб’ёме адзіную крышталічную рашотку.
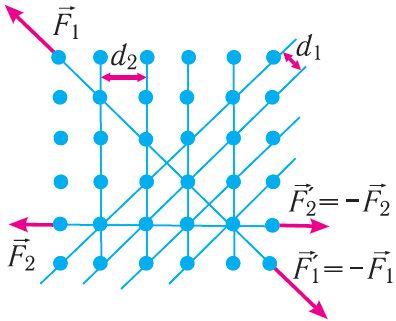
Характэрнай асаблівасцю монакрышталёў з’яўляецца іх анізатрапія, гэта значыць залежнасць фізічных уласцівасцей (механічных, цеплавых, электрычных, аптычных) ад напрамку ўнутры крышталя. Анізатрапія монакрышталёў абумоўлена адрозненнем у шчыльнасці размяшчэння часціц у крышталічнай рашотцы па розных напрамках. На малюнку 47 паказана, што адлегласці паміж атамнымі плоскасцямі ў крышталі неаднолькавыя (d1 < d2). Таму, у прыватнасці, будуць адрознівацца і сілы, неабходныя для яго разрыву (F1 > F2). Напрыклад, кавалак слюды даволі лёгка расслаіць у адным з напрамкаў на тонкія пласцінкі, але для таго, каб разарваць яго ў напрамку, які перпендыкулярны пласцінкам, спатрэбяцца вельмі значныя намаганні.
Цікава ведаць
Анізатрапія ўласцівая некаторым матэрыялам біялагічнага паходжання. Напрыклад, касцявым і мышачным тканкам чалавека і жывёл. Ёю валодаюць таксама драўніна і лісце, трава і інш.
Большасць крышталічных цвёрдых цел з’яўляюцца полікрышталямі.
Полікрышталі — цвёрдыя целы, што складаюцца з вялікай колькасці маленькіх крышталёў, якія зрасліся паміж сабой.
У адрозненне ад монакрышталёў полікрышталі ізатропныя, гэта значыць іх уласцівасці аднолькавыя па ўсіх напрамках. Гэта вынік таго, што полікрышталь складаецца з вялікай колькасці хаатычна арыентаваных маленькіх монакрышталёў.
Вы самі можаце ў хатніх умовах вырасціць монакрышталі (мал. 48, а) і полікрышталі (мал. 48, б) меднага купарвасу (сульфату медзі(II) CuSO4).
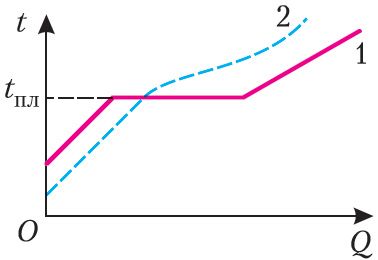
Крышталічныя целы маюць пэўную тэмпературу плаўлення tпл, якая не змяняецца ў працэсе плаўлення пры пастаянным ціску. Залежнасць тэмпературы крышталічнага цела ад атрыманай ім колькасці цеплаты паказана на малюнку 49, графік 1.
1. Чаму шар, выраблены з монакрышталя, пры награванні змяняе не толькі свой аб’ём, але і форму?
2. Ці будзе пры награванні шара, вырабленага са сталі, змяняцца не толькі аб’ём, але і форма?
Аморфныя целы. Да аморфных (ад грэч. аmorphous — бясформенны) цел адносяць апал, абсідыян, эбаніт, сургуч (мал. 50), шкло, розныя пластмасы, смолы (вар, каніфоль, бурштын) і інш.
Аморфны стан — цвёрды некрышталічны стан рэчыва, які характарызуецца ізатрапіяй уласцівасцей і адсутнасцю пэўнай тэмпературы плаўлення.
Залежнасць тэмпературы аморфнага цела ад атрыманай ім колькасці цеплаты паказана на малюнку 49, графік 2. Пры павышэнні тэмпературы аморфнае рэчыва размякчаецца і паступова пераходзіць у вадкі стан. У аморфным стане адсутнічае строгі парадак у размяшчэнні атамаў і малекул. Аморфны стан — бясформенны стан са слаба выяўленай цякучасцю.
Аморфныя целы называюць пераахалоджанымі вадкасцямі, бо ў іх, як і ў вадкасцях, існуе толькі блізкі парадак размяшчэння часціц.
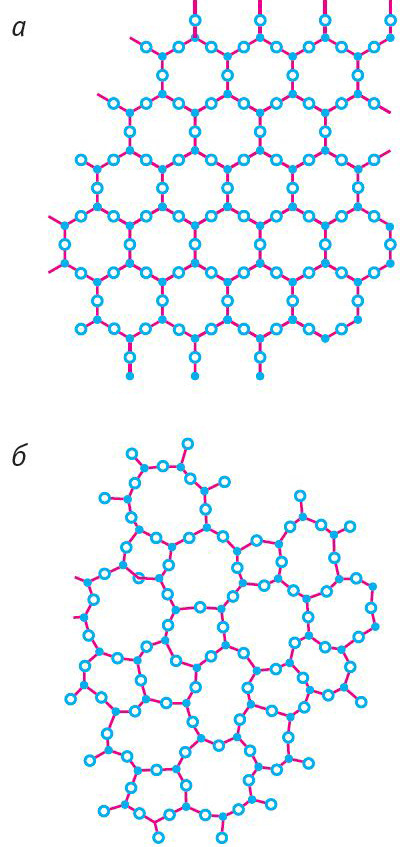
На малюнках 51 схематычна паказана будова крышталічнага кварцу (мал. 51, а) і аморфнага кварцу (мал. 51, б).

Аморфныя целы пры пэўных умовах могуць крышталізавацца. Цукар-пясок з’яўляецца крышталічным целам (мал. 52, а). Калі яго расплавіць, то, застываючы, ён ператвараецца ў празрысты шклопадобны ледзянец (мал. 52, б), які з’яўляецца аморфным целам. Праз некаторы прамежак часу ледзянец «зацукроўваецца», гэта значыць зноў робіцца крышталічным.
Пры хуткасцях ахаладжэння, якія перавышаюць мільён градусаў у секунду, удалося атрымаць аморфныя металічныя сплавы — шклопадобныя металы. Аморфны метал надзвычай цвёрды і трывалы. Яго выкарыстоўваюць у якасці рэжучага інструмента. Ён валодае высокімі магнітнымі ўласцівасцямі, таму з’яўляецца незаменным пры вырабе магнітных галовак для гука- і відэазапісу. Акрамя таго, аморфныя металы валодаюць высокай антыкаразійнай устойлівасцю.
1. Ёсць дзве тонкія пласцінкі, пакрытыя воскам. Да пласцінак па чарзе дакрануліся гарачай спіцай. На адной пласцінцы пры плаўленні воску ўтварылася круглая пляма, а на другой — авальная. Якое з гэтых цел крышталічнае, а якое аморфнае?
2. У дзвюх пасудзінах неабходна расплавіць два цвёрдыя целы. Як, назіраючы за працэсам плаўлення, можна вызначыць, якое з гэтых цел крышталічнае, а якое аморфнае?
Цікава ведаць
Шкло валодае цякучасцю нават пры нармальных умовах, хоць і цячэ вельмі павольна. У старых будынках, дзе вокны даўно не мянялі, можна заўважыць паступовае патаўшчэнне шыбін да нізу.
1. Якія целы называюць цвёрдымі?
2. Якія асаблівасці будовы крышталічных цвёрдых цел?
3. Якія тыпы крышталёў вы ведаеце? Чым яны адрозніваюцца адзін ад аднаго?
4. У чым адрозненне паміж мона- і полікрышталямі?
5. У чым адрозненне паміж паняццямі «анізатрапія» і «ізатрапія»?
6. Чым адрозніваюцца асноўныя фізічныя ўласцівасці крышталічных і аморфных цел?
Правядзіце назіранне за ростам крышталёў. Для гэтага прыгатуйце насычаны раствор кухоннай солі ў пасудзіне з гарачай вадой (раствор становіцца насычаным, калі соль перастае растварацца ў вадзе і пачынае асядаць на дно). Працадзіце раствор, пераліваючы ў іншую посудзіну. У астылы раствор апусціце нітку з прывязаным да яе крышталікам солі. Другі канец ніткі замацуйце на стрыжні, які змясціце на край пасудзіны. Назірайце за ростам крышталя на працягу некалькіх дзён.
Якая форма вырашчанага вамі крышталя? Ці з’яўляецца ён полікрышталём?