§ 48. Бялкі
Уласцівасці бялкоў
Як мы ўжо пераканаліся, магчыма існаванне велізарнага мноства розных бялкоў. У залежнасці ад будовы амінакіслотных астаткаў і іх паслядоўнасці ў поліпептыдным ланцугу, уласцівасці бялкоў могуць істотна адрознівацца. Напрыклад, бялок курынага яйка альбумін раствараецца ў вадзе, у той жа час бялкі кераціны, якія ўваходзяць у састаў валасоў і пазногцяў, нерастваральныя ў вадзе. Разгледзім некаторыя хімічныя ўласцівасці бялкоў.
1. Гідроліз
Бялкі падвяргаюцца гідролізу. Пры гэтым адбываецца паступовае расшчапленне малекулы бялку. Спачатку ўтвараюцца прадукты частковага расшчаплення — пептыды, якія маюць малекулярную масу меншую, чым у зыходнага бялку. Канчатковымі прадуктамі гідролізу з’яўляюцца α-амінакіслоты, з якіх пабудавана малекула бялку. Разгледзім рэакцыю гідролізу на прыкладзе трыпептыду, які складаецца з астаткаў фенілаланіну, аланіну і гліцыну:
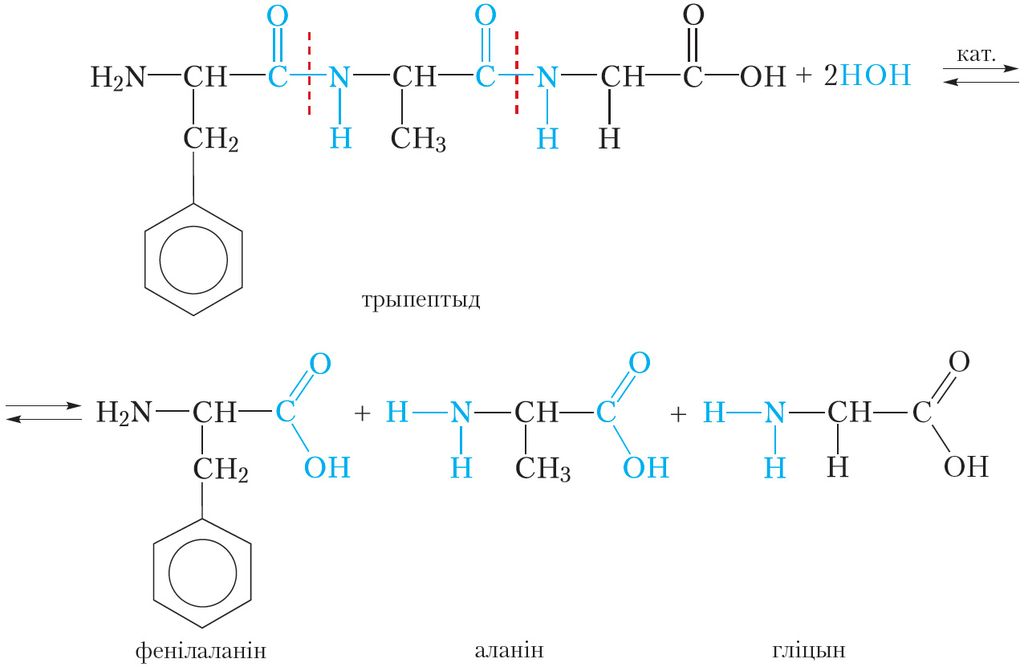
Пры гідролізе адбываецца разрыў пептыдных сувязей у малекуле бялку. У якасці каталізатараў рэакцыі гідролізу бялку можна выкарыстоўваць кіслоты або шчолачы. У жывых арганізмах гідроліз бялкоў каталізуюць ферменты.
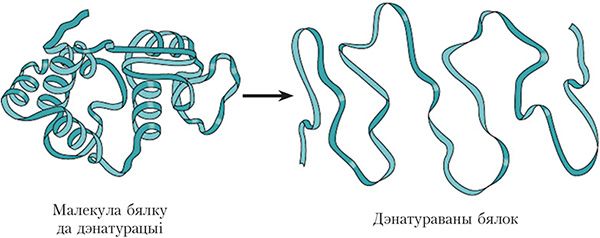
2. Дэнатурацыя
Пад дзеяннем розных фактараў (награванне, дзеянне кіслот, шчолачаў і інш.) можа адбыцца парушэнне прасторавай структуры малекулы бялку (мал. 48.2). Такі працэс называецца дэнатурацыяй. Напрыклад, дэнатурацыя бялку адбываецца пры варцы яек. У выніку дэнатурацыі бялок губляе характэрныя для яго біяхімічныя ўласцівасці.
рэакцыі бялкоў
3. Біурэтавая рэакцыя (якасная рэакцыя на бялкі)
Біурэтавая рэакцыя з’яўляецца якаснай рэакцыяй на бялкі. Калі да воднага раствору бялку, які змяшчае крыху шчолачы, дабавіць раствор сульфату медзі(II), то ўтвараецца складанае комплекснае злучэнне і раствор набывае чырвона-фіялетавую афарбоўку. У біурэтавую рэакцыю ўступаюць рэчывы, якія змяшчаюць пептыдныя сувязі.
4. Ксантапратэінавая рэакцыя
Ксантапратэінавая рэакцыя дазваляе выявіць у бялках астаткі амінакіслот, якія змяшчаюць бензольнае кольца, напрыклад, фенілаланіну і тыразіну (табл. 48.1). Пры дзеянні канцэнтраванай азотнай кіслаты адбываецца нітраванне бензольных кольцаў малекул такіх амінакіслот:
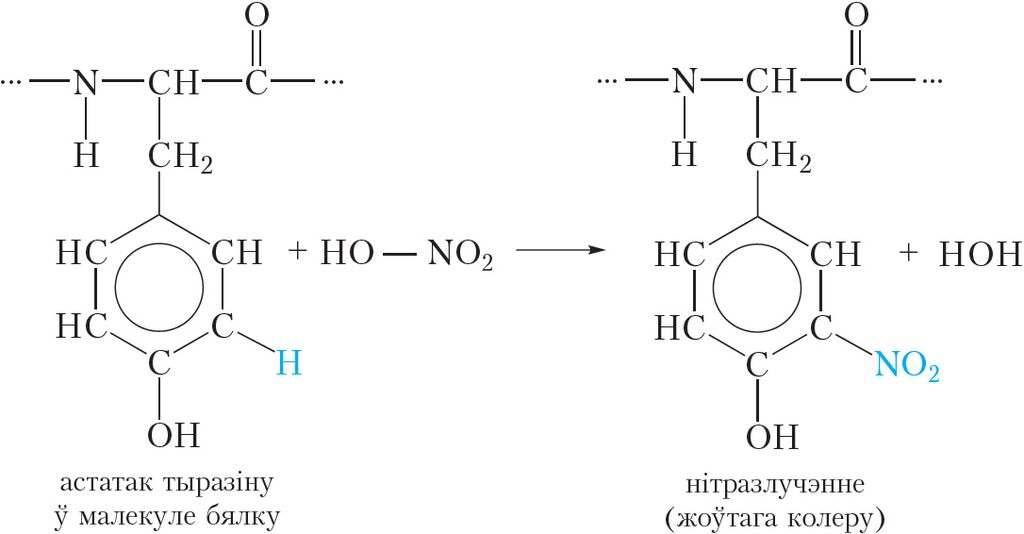
У выніку рэакцыі атамы вадароду ў бензольных кольцах фенілаланіну і тыразіну замяшчаюцца на нітрагруппы ![]() NO2 і з’яўляецца жоўтая афарбоўка.
NO2 і з’яўляецца жоўтая афарбоўка.
У бялках скуры змяшчаецца вялікая колькасць астаткаў араматычных амінакіслот. Таму пры пападанні азотнай кіслаты на скуру на ёй з’яўляюцца жоўтыя плямы.
Бялкі ў жывым арганізме выконваюць мноства функцый. З бялкоў складаюцца тканкі органаў. Каталізатарамі і рэгулятарамі біяхімічных працэсаў выступаюць ферменты і гармоны — бялковыя малекулы, кожны від якіх рэгулюе асобны працэс. Высокая выбіральнасць ферменту абумоўлена яго ўнікальнай будовай.
Бялок інсулін выконвае важную ролю ў абмене рэчываў — ён рэгулюе вугляводны абмен, недастатковая выпрацоўка гэтага бялку падстраўнікавай залозай прыводзіць да цяжкага захворвання — цукровага дыябету.
Бялкі — важнейшы кампанент ежы. Калі асноўнымі крыніцамі энергіі для жывога арганізма з’яўляюцца тлушчы і вугляводы, бялковы кампанент служыць у першую чаргу крыніцай амінакіслот для біясінтэзу бялкоў. Пры гэтым бялкі ежы расшчапляюцца на асобныя амінакіслоты, з якіх потым ажыццяўляецца біясінтэз. У сувязі з гэтым адрозніваюць заменныя і незаменныя амінакіслоты. Заменныя амінакіслоты могуць быць сінтэзаваны ў арганізме чалавека з іншых кампанентаў ежы, незаменныя не могуць быць сінтэзаваны, таму абавязкова павінны паступаць у арганізм з ежай. Прыклады заменных амінакіслот — гліцын і аланін; незаменных — фенілаланін (табл. 48.1).
У заключэнне адзначым, што, знаёмячыся з арганічнай хіміяй, мы прайшлі шлях ад найпрасцейшых арганічных рэчываў — вуглевадародаў — да бялкоў. Далейшае вывучэнне арганічнай хіміі і біялогіі дазволіць прыадчыніць яшчэ шмат таямніц жывога свету.
Малекулы бялкоў пабудаваны з астаткаў α-амінакіслот, якія злучаны пептыднымі сувязямі.
Малекулы бялкоў звычайна змяшчаюць сотні і нават тысячы амінакіслотных астаткаў. Пры гэтым найбольш часта ў саставе бялкоў сустракаюцца астаткі толькі 20 розных амінакіслот.
Бялкі падвяргаюцца гідролізу. Канчатковымі прадуктамі гідролізу з’яўляюцца α-амінакіслоты, з якіх пабудавана малекула бялку.
Пры награванні, дзеянні кіслот, шчолачаў і пад дзеяннем іншых фактараў адбываецца дэнатурацыя бялку. У выніку дэнатурацыі бялок губляе характэрныя для яго біяхімічныя ўласцівасці.
Якаснай рэакцыяй на бялкі з’яўляецца біурэтавая рэакцыя.
Бялкі, якія змяшчаюць астаткі араматычных амінакіслот, даюць жоўтае афарбоўванне з азотнай кіслатой (ксантапратэінавая рэакцыя).
Адрозніваюць заменныя і незаменныя амінакіслоты бялкоў.
