§ 48. Бялкі
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 48. Бялкі |
| Напечатано:: | Гость |
| Дата: | Пятница, 4 Июль 2025, 04:10 |
Бялкі
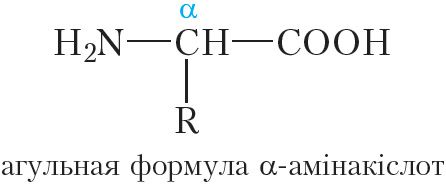
Малекулы бялкоў пабудаваны з астаткаў α-амінакіслот:
Утварэнне малекулы бялку з α-амінакіслот можна прадставіць наступнай схемай:
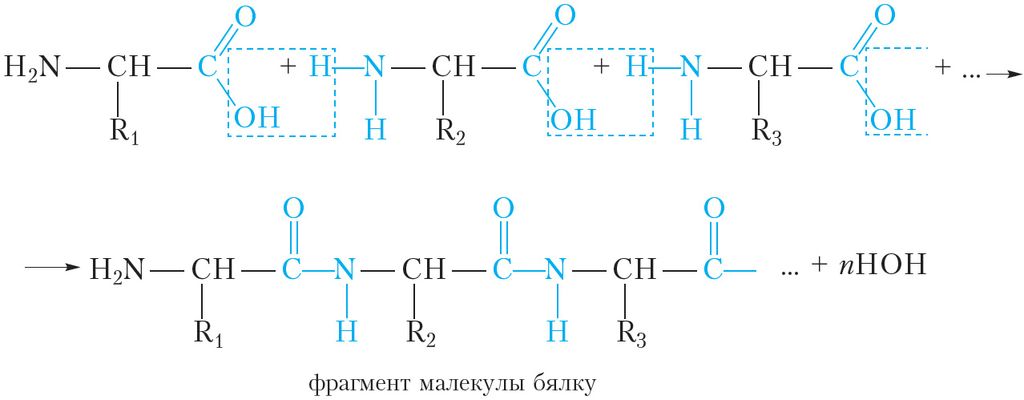
Відаць, што ў малекулах бялкоў амінакіслотныя астаткі злучаны пептыднымі сувязямі, такім чынам, бялкі з’яўляюцца поліпептыдамі.
Малекулы бялкоў звычайна змяшчаюць сотні і нават тысячы амінакіслотных астаткаў. Пры гэтым найбольш часта ў саставе бялкоў сустракаюцца астаткі 20 розных амінакіслот (табл. 48.1).
| Формула | Назва | Абазначэнне |
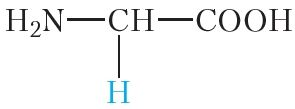 |
гліцын | глі |
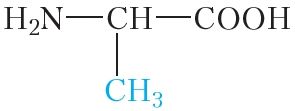 |
аланін | ала |
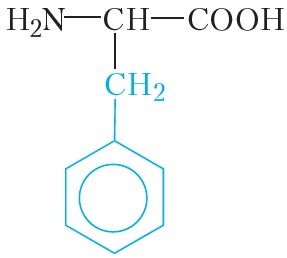 |
фенілаланін | фен |
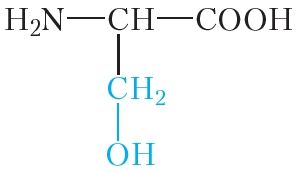 |
серын | сер |
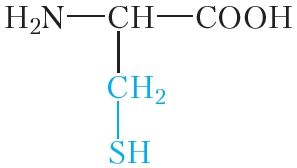 |
цыстэін | цыс |
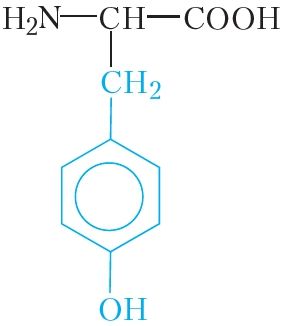 |
тыразін | тыр |
Астаткі гэтых амінакіслот размешчаны ў макрамалекулах бялку ў строга вызначанай паслядоўнасці (мал. 48.1).
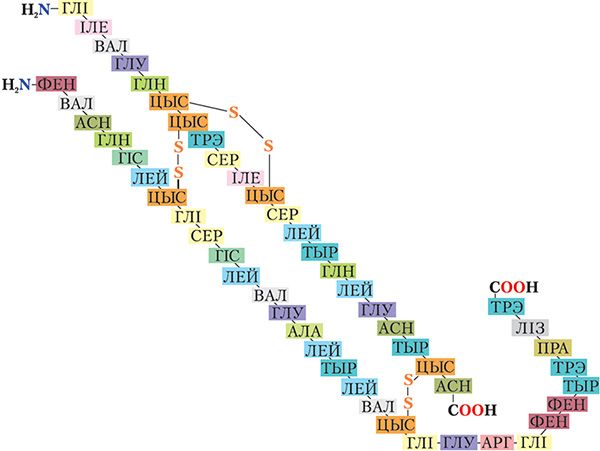
З малюнка 48.1 відаць, што малекула бялку інсуліну складаецца з двух поліпептыдных ланцугоў, злучаных двума дысульфіднымі масткамі (![]() S
S ![]() S
S ![]() ). Кожны поліпептыдны ланцуг характарызуецца строга вызначанай паслядоўнасцю амінакіслотных астаткаў, прычым астаткі многіх амінакіслот сустракаюцца ў малекуле інсуліну некалькі разоў. Напрыклад, з малюнка 48.1 відаць, што астатак гліцыну (глі) сустракаецца ў малекуле інсуліну чатыры разы.
). Кожны поліпептыдны ланцуг характарызуецца строга вызначанай паслядоўнасцю амінакіслотных астаткаў, прычым астаткі многіх амінакіслот сустракаюцца ў малекуле інсуліну некалькі разоў. Напрыклад, з малюнка 48.1 відаць, што астатак гліцыну (глі) сустракаецца ў малекуле інсуліну чатыры разы.
На першы погляд можа здацца, што выкарыстанне 20 розных амінакіслот для пабудовы малекул бялкоў істотна абмяжоўвае разнастайнасць бялковых структур. На самай справе колькасць камбінацый, якую можна скласці, выкарыстоўваючы для пабудовы поліпептыдных ланцугоў 20 розных амінакіслот, практычна бясконцая. Напрыклад, калі поліпептыдны ланцуг будзе складацца са 100 амінакіслотных астаткаў, то, выкарыстоўваючы для яго пабудовы 20 розных амінакіслот, можна скласці 20100 камбінацый!
Уласцівасці бялкоў
Як мы ўжо пераканаліся, магчыма існаванне велізарнага мноства розных бялкоў. У залежнасці ад будовы амінакіслотных астаткаў і іх паслядоўнасці ў поліпептыдным ланцугу, уласцівасці бялкоў могуць істотна адрознівацца. Напрыклад, бялок курынага яйка альбумін раствараецца ў вадзе, у той жа час бялкі кераціны, якія ўваходзяць у састаў валасоў і пазногцяў, нерастваральныя ў вадзе. Разгледзім некаторыя хімічныя ўласцівасці бялкоў.
1. Гідроліз
Бялкі падвяргаюцца гідролізу. Пры гэтым адбываецца паступовае расшчапленне малекулы бялку. Спачатку ўтвараюцца прадукты частковага расшчаплення — пептыды, якія маюць малекулярную масу меншую, чым у зыходнага бялку. Канчатковымі прадуктамі гідролізу з’яўляюцца α-амінакіслоты, з якіх пабудавана малекула бялку. Разгледзім рэакцыю гідролізу на прыкладзе трыпептыду, які складаецца з астаткаў фенілаланіну, аланіну і гліцыну:
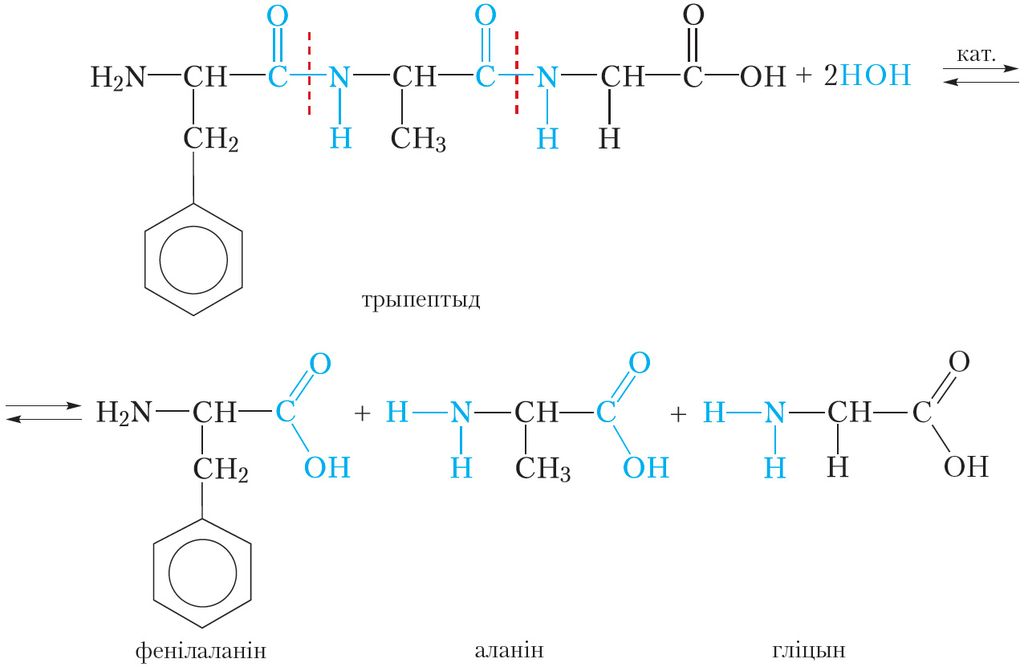
Пры гідролізе адбываецца разрыў пептыдных сувязей у малекуле бялку. У якасці каталізатараў рэакцыі гідролізу бялку можна выкарыстоўваць кіслоты або шчолачы. У жывых арганізмах гідроліз бялкоў каталізуюць ферменты.
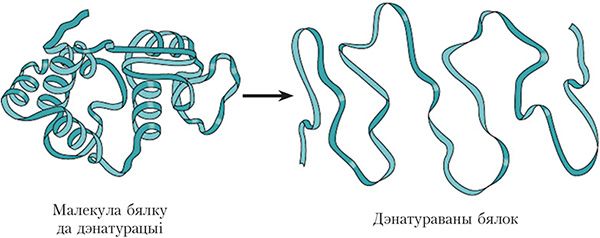
2. Дэнатурацыя
Пад дзеяннем розных фактараў (награванне, дзеянне кіслот, шчолачаў і інш.) можа адбыцца парушэнне прасторавай структуры малекулы бялку (мал. 48.2). Такі працэс называецца дэнатурацыяй. Напрыклад, дэнатурацыя бялку адбываецца пры варцы яек. У выніку дэнатурацыі бялок губляе характэрныя для яго біяхімічныя ўласцівасці.
рэакцыі бялкоў
3. Біурэтавая рэакцыя (якасная рэакцыя на бялкі)
Біурэтавая рэакцыя з’яўляецца якаснай рэакцыяй на бялкі. Калі да воднага раствору бялку, які змяшчае крыху шчолачы, дабавіць раствор сульфату медзі(II), то ўтвараецца складанае комплекснае злучэнне і раствор набывае чырвона-фіялетавую афарбоўку. У біурэтавую рэакцыю ўступаюць рэчывы, якія змяшчаюць пептыдныя сувязі.
4. Ксантапратэінавая рэакцыя
Ксантапратэінавая рэакцыя дазваляе выявіць у бялках астаткі амінакіслот, якія змяшчаюць бензольнае кольца, напрыклад, фенілаланіну і тыразіну (табл. 48.1). Пры дзеянні канцэнтраванай азотнай кіслаты адбываецца нітраванне бензольных кольцаў малекул такіх амінакіслот:
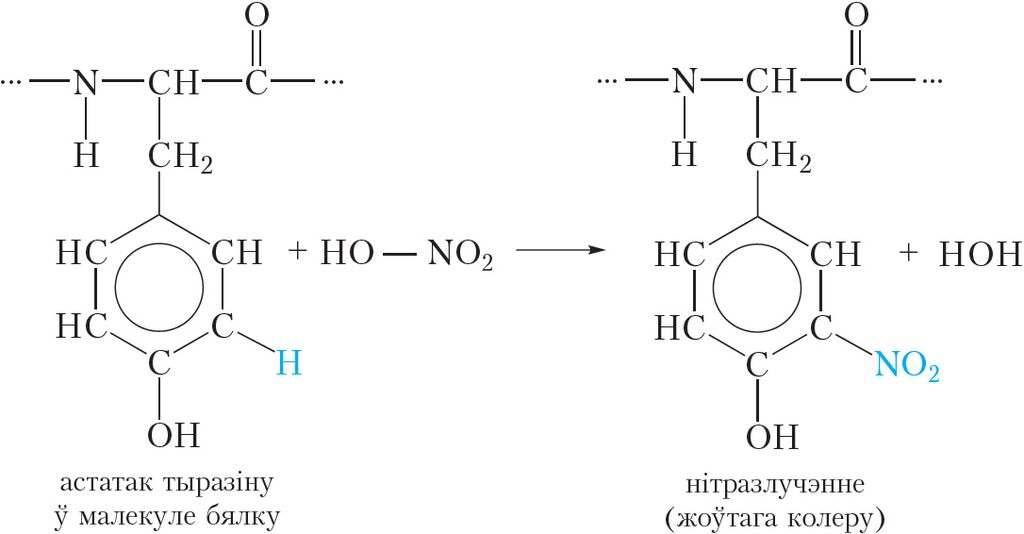
У выніку рэакцыі атамы вадароду ў бензольных кольцах фенілаланіну і тыразіну замяшчаюцца на нітрагруппы ![]() NO2 і з’яўляецца жоўтая афарбоўка.
NO2 і з’яўляецца жоўтая афарбоўка.
У бялках скуры змяшчаецца вялікая колькасць астаткаў араматычных амінакіслот. Таму пры пападанні азотнай кіслаты на скуру на ёй з’яўляюцца жоўтыя плямы.
Бялкі ў жывым арганізме выконваюць мноства функцый. З бялкоў складаюцца тканкі органаў. Каталізатарамі і рэгулятарамі біяхімічных працэсаў выступаюць ферменты і гармоны — бялковыя малекулы, кожны від якіх рэгулюе асобны працэс. Высокая выбіральнасць ферменту абумоўлена яго ўнікальнай будовай.
Бялок інсулін выконвае важную ролю ў абмене рэчываў — ён рэгулюе вугляводны абмен, недастатковая выпрацоўка гэтага бялку падстраўнікавай залозай прыводзіць да цяжкага захворвання — цукровага дыябету.
Бялкі — важнейшы кампанент ежы. Калі асноўнымі крыніцамі энергіі для жывога арганізма з’яўляюцца тлушчы і вугляводы, бялковы кампанент служыць у першую чаргу крыніцай амінакіслот для біясінтэзу бялкоў. Пры гэтым бялкі ежы расшчапляюцца на асобныя амінакіслоты, з якіх потым ажыццяўляецца біясінтэз. У сувязі з гэтым адрозніваюць заменныя і незаменныя амінакіслоты. Заменныя амінакіслоты могуць быць сінтэзаваны ў арганізме чалавека з іншых кампанентаў ежы, незаменныя не могуць быць сінтэзаваны, таму абавязкова павінны паступаць у арганізм з ежай. Прыклады заменных амінакіслот — гліцын і аланін; незаменных — фенілаланін (табл. 48.1).
У заключэнне адзначым, што, знаёмячыся з арганічнай хіміяй, мы прайшлі шлях ад найпрасцейшых арганічных рэчываў — вуглевадародаў — да бялкоў. Далейшае вывучэнне арганічнай хіміі і біялогіі дазволіць прыадчыніць яшчэ шмат таямніц жывога свету.
Малекулы бялкоў пабудаваны з астаткаў α-амінакіслот, якія злучаны пептыднымі сувязямі.
Малекулы бялкоў звычайна змяшчаюць сотні і нават тысячы амінакіслотных астаткаў. Пры гэтым найбольш часта ў саставе бялкоў сустракаюцца астаткі толькі 20 розных амінакіслот.
Бялкі падвяргаюцца гідролізу. Канчатковымі прадуктамі гідролізу з’яўляюцца α-амінакіслоты, з якіх пабудавана малекула бялку.
Пры награванні, дзеянні кіслот, шчолачаў і пад дзеяннем іншых фактараў адбываецца дэнатурацыя бялку. У выніку дэнатурацыі бялок губляе характэрныя для яго біяхімічныя ўласцівасці.
Якаснай рэакцыяй на бялкі з’яўляецца біурэтавая рэакцыя.
Бялкі, якія змяшчаюць астаткі араматычных амінакіслот, даюць жоўтае афарбоўванне з азотнай кіслатой (ксантапратэінавая рэакцыя).
Адрозніваюць заменныя і незаменныя амінакіслоты бялкоў.
Пытанні і заданні
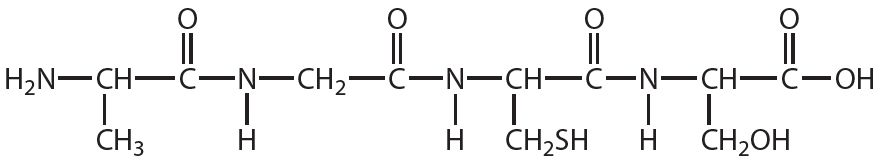
1. Укажыце лік пептыдных сувязей у малекуле рэчыва, формула якога:
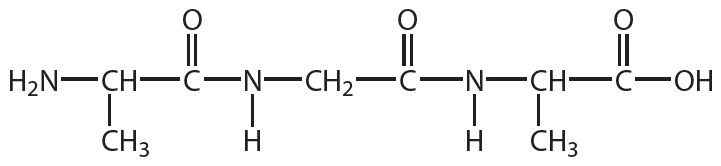
2. Напішыце ўраўненне рэакцыі гідролізу рэчыва, формула якога:
3. Пры поўным гідролізе трыпептыду атрымана сумесь аланіну і фенілаланіну ў мольных суадносінах 2 : 1. Састаўце ўсе магчымыя формулы трыпептыду.
4. Пры поўным гідролізе трыпептыду атрымана сумесь гліцыну, аланіну і фенілаланіну. Састаўце ўсе магчымыя формулы трыпептыду.
5. У малекуле інсуліну чалавека змяшчаецца 6 атамаў серы (мал. 48.1). Масавая доля серы ў інсуліне роўна 3,3 %. Ацаніце малярную масу інсуліну.
6. Пры поўным гідролізе 16,5 г дыпептыду ўтварылася толькі адна амінакіслата. Яе маса роўна 18,75 г. Устанавіце будову дыпептыду.
7. Пры шчолачным гідролізе 16,0 г дыпептыду ўтварылася толькі адно арганічнае рэчыва — натрыевая соль адной з амінакіслот. Маса гэтай солі роўна 22,2 г. Устанавіце будову дыпептыду.
8*. Пры поўным кіслотным гідролізе некаторага пентапептыду атрыманы тры амінакіслаты — гліцын, аланін і фенілаланін у мольных адносінах 3 : 1 : 1. Пры частковым гідролізе гэтага ж пентапептыду былі вылучаны тры трыпептыды і тры дыпептыды. Вызначэнне N-канцавых амінакіслот у трох трыпептыдах паказала, што ў двух імі з’яўляецца гліцын, а ў трэцім — аланін. Вызначце паслядоўнасць амінакіслот у малекуле пентапептыду і напішыце яго структурную формулу.
