§ 19. Араматычныя вуглевадароды. Бензол, будова малекулы
Араматычныя вуглевадароды. Бензол, будова малекулы
Назва «араматычныя злучэнні» ўзнікла таму, што першыя вядомыя прадстаўнікі гэтага класа, атрыманыя яшчэ на пачатку XIX стагоддзя, мелі прыемны пах. Пазней аказалася, што большасць рэчываў, якія па будове і хімічных уласцівасцях належаць да гэтай групы, не маюць прыемнага паху. Аднак агульная назва гэтых злучэнняў захавалася.
Найпрасцейшым прадстаўніком араматычных вуглевадародаў з’яўляецца бензол. Яго малекулярная формула C6H6.
Бензол — лёгкакіпячая (tкіп = 80 °С), бясколерная, нерастваральная ў вадзе вадкасць з характэрным пахам. Пры ахалоджванні ён лёгка застывае ў белую крышталічную масу з тэмпературай плаўлення 5,5 °С.
Адкрыў бензол вялікі англійскі фізік Майкл Фарадэй. У 1825 годзе яму ўдалося вылучыць бензол з каменнавугальнай смалы. Пазней былі ўстаноўлены найпрасцейшая CH і малекулярная C6H6 формулы бензолу. Аднак доўгі час не ўдавалася ўстанавіць будову малекулы дадзенага рэчыва. Праз сорак гадоў пасля адкрыцця бензолу нямецкі хімік Аўгуст Кекуле зрабіў правільную здагадку аб цыклічнай будове малекулы бензолу і прапанаваў наступную структурную формулу:
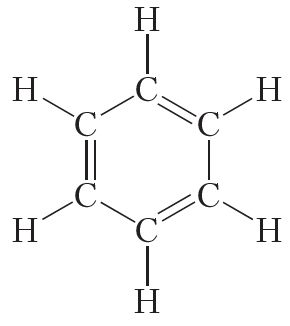
Прадстаўленая формула бензолу называецца формулай Кекуле. Формула Кекуле паказвае, што малекула бензолу мае плоскую будову, валентныя вуглы роўныя 120°. З формулы Кекуле таксама вынікае, што для гідрыравання малекулы бензолу да цыклагексану патрабуюцца тры малекулы вадароду:
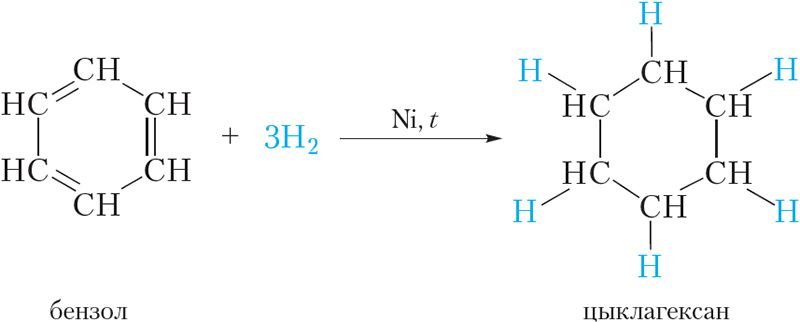
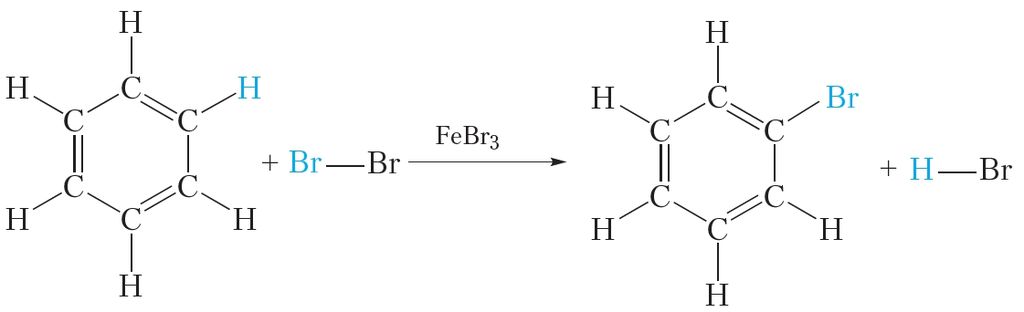
Усе гэтыя вывады пацвярджаюцца эксперыментальнымі данымі. Аднак формула Кекуле не тлумачыць рада асаблівых уласцівасцей бензолу. Так, бензол не ўступае ў якасныя рэакцыі на двайную C ![]() C сувязь. Ён, у адрозненне ад алкенаў, не абясколервае бромную ваду і раствор перманганату калію. У прысутнасці каталізатара бензол рэагуе з галагенамі, аднак пры гэтым адбываецца не далучэнне галагену, а замяшчэнне атама вадароду ў малекуле бензолу на галаген:
C сувязь. Ён, у адрозненне ад алкенаў, не абясколервае бромную ваду і раствор перманганату калію. У прысутнасці каталізатара бензол рэагуе з галагенамі, аднак пры гэтым адбываецца не далучэнне галагену, а замяшчэнне атама вадароду ў малекуле бензолу на галаген:
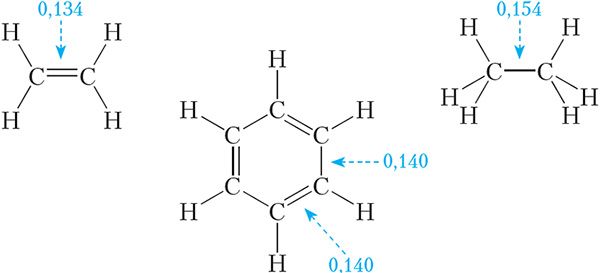
Акрамя таго, эксперыментальна ўстаноўлена, што ўсе сувязі вугляродвуглярод у малекуле бензолу маюць аднолькавую даўжыню. Настолькі незвычайныя ўласцівасці бензолу атрымалася растлумачыць толькі ў ХХ стагоддзі, выкарыстоўваючы сучасную тэорыю будовы рэчыва.
З формулы Кекуле вынікае, што двайныя сувязі ў малекуле бензолу з’яўляюцца спалучанымі. На прыкладзе бутадыену-1,3 мы бачылі, што спалучэнне вядзе да некаторага выраўноўвання даўжынь двайных і адзінарных сувязей. У малекуле бензолу спалучэнне настолькі моцнае, што даўжыні ўсіх сувязей вуглярод-вуглярод становяцца аднолькавымі:
Такім чынам, у малекуле бензолу няма двайных і адзінарных сувязей. Кожны атам вугляроду ў малекуле бензолу, як і ў бутадыене-1,3, знаходзіцца ў стане sp2-гібрыдызацыі. π-Электроны дэлакалізаваны і ўтвараюць не тры асобныя π-сувязі, а адзіную π-сістэму (спалучаную сістэму π-сувязей):
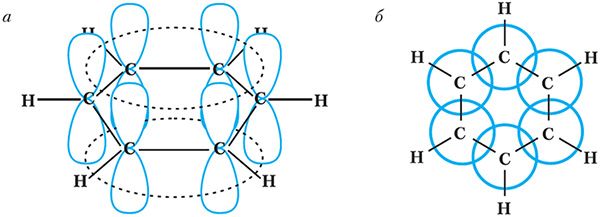
а — від збоку; б — від зверху
Паколькі π-электроны размяркоўваюцца ў малекуле бензолу раўнамерна паміж усімі атамамі вугляроду, то сувязі паміж усімі атамамі вугляроду аказваюцца цалкам аднолькавымі.
Каб паказаць раўнамернасць размеркавання π-электронаў у малекуле бензолу, яго структурную формулу часта малююць у выглядзе шасцівугольніка з акружнасцю ўсярэдзіне:
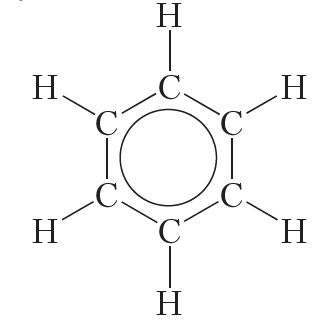
У дадзенай формуле шасцівугольнік адлюстроўвае σ-сувязі паміж атамамі вугляроду, а акружнасць — сістэму π-сувязей.
Шарастрыжнёвая мадэль малекулы бензолу:
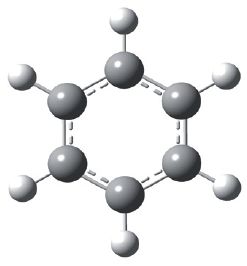
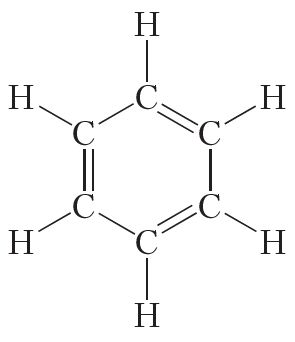
Нараўне з формулай бензолу, у якой паказана дэлакалізацыя π-электронаў, нярэдка карыстаюцца формулай Кекуле, улічваючы пры гэтым, што яна не зусім дакладна перадае будову бензолу:
Шырока выкарыстоўваюцца таксама больш кампактныя шкілетныя формулы бензолу:

Дэлакалізацыя π-электронаў надае малекуле бензолу дадатковую ўстойлівасць. Таму для бензолу характэрны рэакцыі, у якіх спалучаная сістэма π-сувязей у малекуле захоўваецца. Такімі рэакцыямі з’яўляюцца рэакцыі замяшчэння (гл. ураўненне рэакцыі з бромам).
Як ужо адзначалася, бензол з’яўляецца найпрасцейшым прадстаўніком араматычных вуглевадародаў. Яго гамолагі могуць разглядацца як прадукты замяшчэння аднаго або некалькіх атамаў вадароду ў малекуле бензолу на вуглевадародныя радыкалы. Формулы і назвы некаторых гамолагаў бензолу прыведзены на малюнку 19.3.
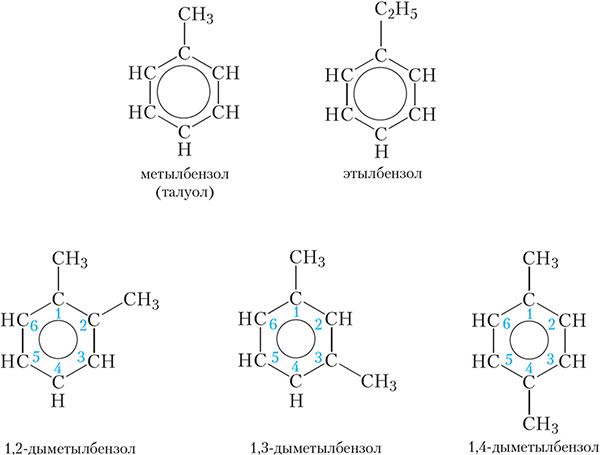
Як бачна, для пабудовы назваў рэчываў, у малекулах якіх з бензольным кольцам злучана некалькі вуглевадародных радыкалаў, атамы вугляроду бензольнага кольца нумаруюць такім чынам, каб замяшчальнікі атрымалі найменшыя нумары, і пры дапамозе лічбаў у назве паказваюць становішча замяшчальнікаў.
Бензол С6Н6 — найпрасцейшы прадстаўнік класа араматычных вуглевадародаў.
Малекула бензолу мае плоскую будову, валентныя вуглы роўныя 120°, даўжыні ўсіх сувязей вуглярод-вуглярод аднолькавыя.
π-Электроны ў малекуле бензолу дэлакалізаваны і ўтвараюць адзіную спалучаную сістэму π-сувязей.
Спалучаная сістэма π-сувязей надае малекуле бензолу павышаную ўстойлівасць, таму для бензолу характэрны рэакцыі, у якіх спалучаная сістэма захоўваецца.