§ 18. Алкіны
Хімічныя ўласцівасці алкінаў
Хімічныя ўласцівасці алкінаў сходны з ўласцівасцямі алкенаў, так як у малекулах рэчываў абодвух класаў маецца кратная сувязь. Характэрнымі для алкінаў з’яўляюцца рэакцыі далучэння па трайной сувязі, якія суправаджаюцца разрывам π-сувязей, бо яны менш трывалыя, чым σ-сувязь. Таксама як і алкены, алкіны могуць далучаць галагены, вадарод, галагенавадароды, прычым адна малекула алкіну можа далучыць дзве малекулы ўказаных рэчываў.
1. Галагенаванне. Далучэнне галагенаў
Алкіны, падобна алкенам, абясколерваюць бромную ваду:
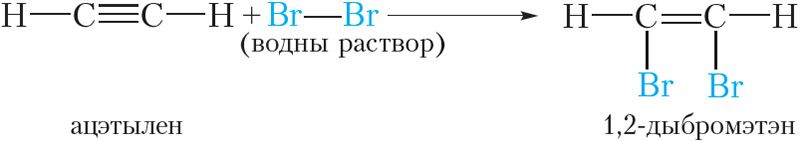
1,2-Дыбромэтэн, які ўтвараецца, змяшчае двайную сувязь, таму пры лішку брому ўступае ў рэакцыю далучэння. У выніку ўтвараецца тэтрабромвытворнае алкану:
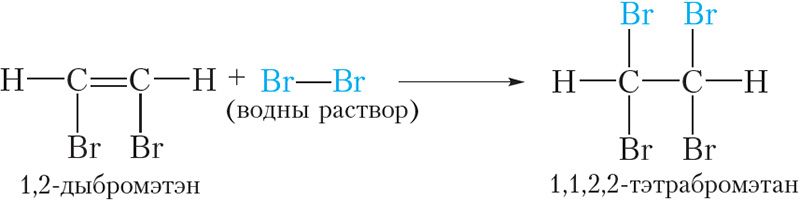
У адрозненне ад алкенаў, састаў прадуктаў рэакцыі алкінаў з бромам залежыць ад колькасных суадносін рэагентаў. Пры недахопе брому могуць утварацца злучэнні, якія змяшчаюць двайную сувязь, у той час як у лішку утвараюцца насычаныя злучэнні.
Дзве папярэднія рэакцыі можна аб’яднаць у адну:
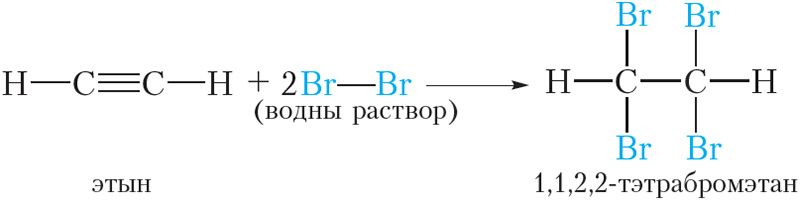
Значыць, пры прапусканні ацэтылену праз бромную ваду працякае рэакцыя далучэння брому па трайной сувязі. У выніку аранжавы раствор брому абясколерваецца. Падобная з’ява назіралася і для алкенаў.
Такім чынам, рэакцыя з бромнай вадой з’яўляецца якаснай рэакцыяй на кратную (двайную ці трайную) сувязь.
Таксама як этылен, ацэтылен абясколервае водны раствор перманганату калію. Такім чынам, рэакцыя з растворам перманганату калію таксама з’яўляецца якаснай рэакцыяй на кратную (двайную ці трайную) сувязь.
2. Гідрыраванне. Далучэнне вадароду
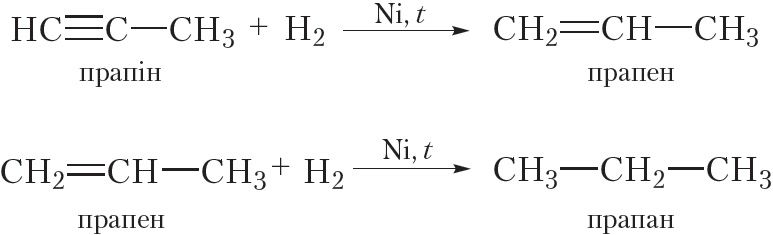
У выніку гідрыравання алкінаў спачатку ўтвараюцца алкены, а потым алканы. Для працякання рэакцыі неабходны каталізатар (Pt або Ni).
Прывядзём ураўненні рэакцый, якія працякаюць пры гідрыраванні прапіну:
3. Гідрагалагенаванне. Далучэнне галагенавадародаў
Алкіны могуць далучаць малекулы складаных рэчываў. У выніку далучэння малекулы хлоравадароду да малекулы ацэтылену ўтвараецца хлорэтэн:

Вуглевадародны радыкал СH2 ![]() CH
CH ![]() мае трывіяльную назву вініл. Таму хлорэтэн (СH2
мае трывіяльную назву вініл. Таму хлорэтэн (СH2 ![]() CH
CH ![]() Cl) часта называюць вінілхларыдам. Вінілхларыд — бясколерны газ са слабым саладкаватым пахам, вельмі ядавіты, tкіп = –14 °С.
Cl) часта называюць вінілхларыдам. Вінілхларыд — бясколерны газ са слабым саладкаватым пахам, вельмі ядавіты, tкіп = –14 °С.
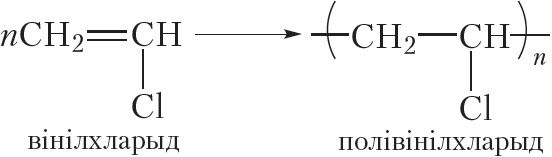
Малекула вінілхларыду змяшчае двайную сувязь, таму ён, падобна алкенам, уступае ў рэакцыю полімерызацыі:
галагенавадародаў
і вады да гамолагаў
ацэтылену
Прадукт рэакцыі полімерызацыі вінілхларыду — полівінілхларыд, або скарочана ПВХ, шырока выкарыстоўваецца для вырабу аконных рам, дзвярэй, лінолеуму, электраізаляцыі правадоў, штучнай скуры і іншых вырабаў.
З асаблівасцямі далучэння галагенавадародаў і вады да гамолагаў ацэтылену вы можаце пазнаёміцца, перайшоўшы па спасылцы ў QR-кодзе.
4. Гарэнне. Узаемадзеянне з кіслародам
Як і ўсе вуглевадароды, алкіны гараць. Ураўненне рэакцыі гарэння ацэтылену:
![]()
Пры гарэнні ацэтылену ў кіслародзе выдзяляецца вялікая колькасць цеплаты, тэмпература полымя настолькі высокая, што ім можна зварваць і рэзаць металы. Таму ацэтыленавае полымя выкарыстоўваецца пры зварцы і рамонце металічных вырабаў.
