§ 18. Алкіны
| Сайт: | Профильное обучение |
| Курс: | Хімія. 10 клас |
| Книга: | § 18. Алкіны |
| Напечатано:: | Гость |
| Дата: | Tuesday, 25 November 2025, 02:33 |
Алкіны
Атамы вугляроду могуць быць звязаны паміж сабой не толькі адзінарнымі ці двайнымі, але таксама трайнымі сувязямі. Найпрасцейшым вуглевадародам, які змяшчае трайную сувязь, з’яўляецца этын, або ацэтылен, НC ![]() СН. Разгледзім яго будову.
СН. Разгледзім яго будову.
Кожны атам вугляроду ў ацэтылене ўтварае чатыры хімічныя сувязі. Утварэнне гэтых сувязей адбываецца за кошт чатырох атамных арбіталей:
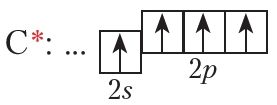
Успомнім будову этылену: 
Атамы вугляроду ў гэтай малекуле знаходзяцца ў стане sp2-гібрыдызацыі. За кошт sp2-гібрыдных арбіталей кожны атам вугляроду ўтварае тры σ-сувязі: дзве сувязі з атамамі вадароду і адну — з суседнім вугляродам:
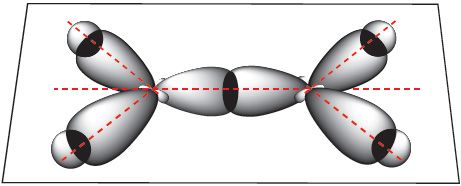
Другая сувязь паміж атамамі вугляроду ўтвараецца за кошт бакавога перакрывання негібрыдных p-арбіталей атамаў вугляроду — гэта π-сувязь:
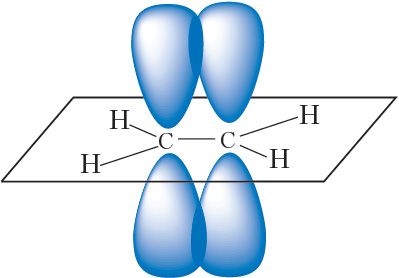
Такім чынам, двайная сувязь складаецца з адной σ- і адной π-сувязі.
У малекуле ацэтылену Н ![]() С
С ![]() С
С ![]() Н маецца трайная сувязь. Яна складаецца з адной σ- і двух π-сувязей. Так як π-сувязі ўтвараюцца за кошт перакрывання негібрыдных p-арбіталей, то ў гібрыдызацыі будуць прымаць удзел адна s- і адна p-арбіталі атамаў вугляроду. Такі тып гібрыдызацыі называецца sp-гібрыдызацыя.
Н маецца трайная сувязь. Яна складаецца з адной σ- і двух π-сувязей. Так як π-сувязі ўтвараюцца за кошт перакрывання негібрыдных p-арбіталей, то ў гібрыдызацыі будуць прымаць удзел адна s- і адна p-арбіталі атамаў вугляроду. Такі тып гібрыдызацыі называецца sp-гібрыдызацыя.
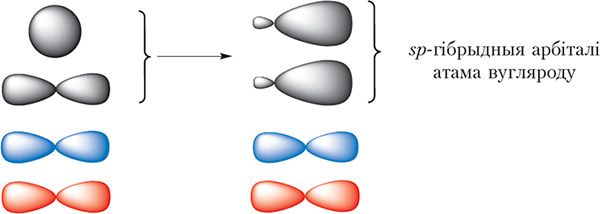
sp-Гібрыдныя арбіталі размяшчаюцца на адной прамой пад вуглом 180°. Дзве р-арбіталі атама вугляроду, якія не ўдзельнічаюць у гібрыдызацыі, захоўваюць сваю першапачатковую форму і размяшчаюцца ўзаемна перпендыкулярна:
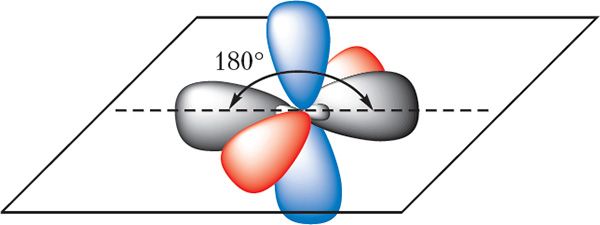
За кошт перакрывання гібрыдных арбіталей кожны атам вугляроду ўтварае дзве σ-сувязі — адну сувязь з атамам вадароду і адну — з суседнім вугляродам:

у малекуле ацэтылену
Арбіталі, якія не ўдзельнічаюць у гібрыдызацыі, фарміруюць дзве π-сувязі паміж атамамі вугляроду:
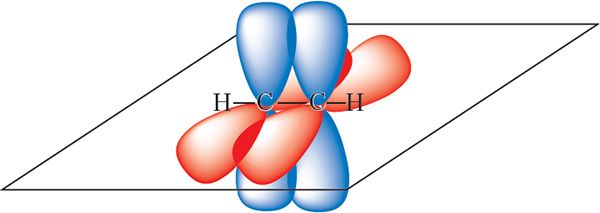
у малекуле ацэтылену
Такім чынам, у малекуле ацэтылену маюцца тры σ-сувязі і дзве π-сувязі:

Малекула ацэтылену лінейная, валентны вугал роўны 180°. Сувязь паміж атамамі вугляроду трайная:
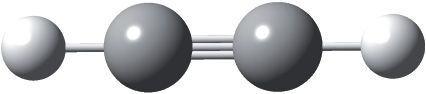
Трайная сувязь карацейшая, чым двайная і адзінарная: у малекуле ацэтылену даўжыня сувязі паміж атамамі вугляроду роўная 0,120 нм. Нагадаем, што ў малекулах этылену і этану даўжыня сувязі паміж атамамі вугляроду складае 0,134 і 0,154 нм адпаведна.
Ацэтылен з’яўляецца найпрасцейшым прадстаўніком алкінаў — нецыклічных вуглевадародаў, малекулы якіх змяшчаюць адну трайную сувязь.
Бліжэйшы гамолаг ацэтылену — прапін СН3 ![]() C
C ![]() СН. Малекулярная формула прапіну С3Н4. Так як суседнія члены гамалагічнага рада адрозніваюцца па саставе на групу СН2, відавочна, што наступны гамолаг павінен мець састаў С4Н6. Адсюль лёгка можна вывесці агульную формулу алкінаў — СnH2n–2. Як вы ўжо ведаеце, агульную формулу СnH2n–2 маюць таксама алкадыены.
СН. Малекулярная формула прапіну С3Н4. Так як суседнія члены гамалагічнага рада адрозніваюцца па саставе на групу СН2, відавочна, што наступны гамолаг павінен мець састаў С4Н6. Адсюль лёгка можна вывесці агульную формулу алкінаў — СnH2n–2. Як вы ўжо ведаеце, агульную формулу СnH2n–2 маюць таксама алкадыены.
Ізамерыя алкінаў
Алкінам, таксама як і алкенам, уласціва ізамерыя становішча кратнай сувязі і ізамерыя вугляроднага шкілета:

Звярніце ўвагу, што ў алкінаў ізамерыя вугляроднага шкілета магчыма пачынаючы з рэчыва, якое змяшчае пяць атамаў вугляроду ў малекуле.
Як ужо ўпаміналася, алкіны і алкадыены маюць аднолькавую агульную формулу CnH2n–2. Таму алкіны будуць ізамерны алкадыенам. Такія ізамеры называюцца міжкласавымі. Напрыклад, формулу C4H6 маюць рэчывы:
![]()
Наменклатура алкінаў
Назвы алкінаў будуюцца таксама, як і назвы алкенаў, але суфікс -ен у канцы назвы замяняецца на суфікс -ін (ён абазначае адну трайную сувязь). Лічбай у канцы назвы ўказваецца становішча трайной сувязі.
Прывядзём некалькі прыкладаў формул і назваў алкінаў:

Звярніце ўвагу:
а) у назве «прапін» няма неабходнасці ўказваць становішча трайной сувязі;
б) атамы вугляроду галоўнага ланцуга нумаруюць пачынаючы з таго канца, да якога бліжэй трайная сувязь.
Фізічныя ўласцівасці
Фізічныя ўласцівасці алкінаў падобныя да ўласцівасцей адпаведных алкенаў. Так, алкіны з лікам атамаў вугляроду ў малекуле 2—4 пры пакаёвай тэмпературы з’яўляюцца бясколернымі газападобнымі рэчывамі. Алкіны з лікам атамаў вугляроду ў малекуле ад 5 да 16 — вадкасці. Алкіны з лікам атамаў вугляроду ў малекуле больш за 16 уяўляюць сабой цвёрдыя рэчывы. Тэмпературы кіпення некаторых алкінаў неразгалінаванай будовы прыведзены ў табліцы 18.1.
| Назва | Структурная формула | Тэмпература кіпення (tкіп, °С) |
| Этын | HС |
–84 |
| Прапін | HС |
–23 |
| Бутын-1 | HС |
–8 |
| Пентын-1 | HС |
39 |
| Гексін-1 | HС |
71 |
| Гептын-1 | HС |
100 |
| Актын-1 | HС |
126 |
Алкіны нерастваральныя ў вадзе, але добра раствараюцца ў арганічных растваральніках.
Шчыльнасць вадкіх і цвёрдых алкінаў меншая, чым у вады.
Хімічныя ўласцівасці алкінаў
Хімічныя ўласцівасці алкінаў сходны з ўласцівасцямі алкенаў, так як у малекулах рэчываў абодвух класаў маецца кратная сувязь. Характэрнымі для алкінаў з’яўляюцца рэакцыі далучэння па трайной сувязі, якія суправаджаюцца разрывам π-сувязей, бо яны менш трывалыя, чым σ-сувязь. Таксама як і алкены, алкіны могуць далучаць галагены, вадарод, галагенавадароды, прычым адна малекула алкіну можа далучыць дзве малекулы ўказаных рэчываў.
1. Галагенаванне. Далучэнне галагенаў
Алкіны, падобна алкенам, абясколерваюць бромную ваду:
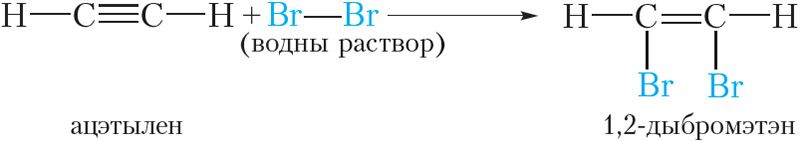
1,2-Дыбромэтэн, які ўтвараецца, змяшчае двайную сувязь, таму пры лішку брому ўступае ў рэакцыю далучэння. У выніку ўтвараецца тэтрабромвытворнае алкану:
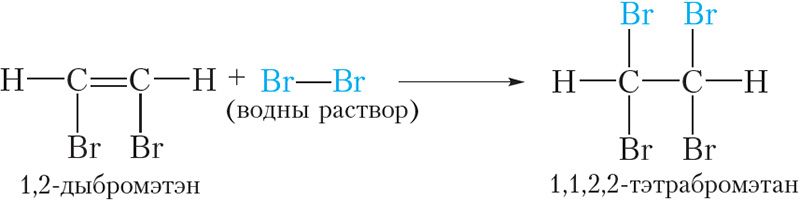
У адрозненне ад алкенаў, састаў прадуктаў рэакцыі алкінаў з бромам залежыць ад колькасных суадносін рэагентаў. Пры недахопе брому могуць утварацца злучэнні, якія змяшчаюць двайную сувязь, у той час як у лішку утвараюцца насычаныя злучэнні.
Дзве папярэднія рэакцыі можна аб’яднаць у адну:
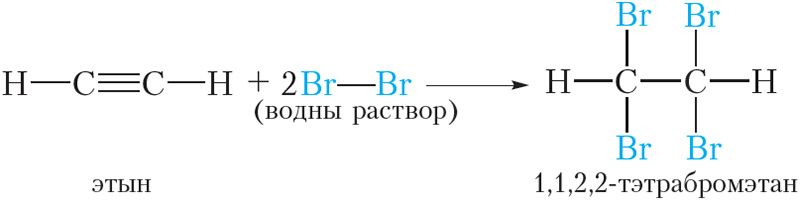
Значыць, пры прапусканні ацэтылену праз бромную ваду працякае рэакцыя далучэння брому па трайной сувязі. У выніку аранжавы раствор брому абясколерваецца. Падобная з’ява назіралася і для алкенаў.
Такім чынам, рэакцыя з бромнай вадой з’яўляецца якаснай рэакцыяй на кратную (двайную ці трайную) сувязь.
Таксама як этылен, ацэтылен абясколервае водны раствор перманганату калію. Такім чынам, рэакцыя з растворам перманганату калію таксама з’яўляецца якаснай рэакцыяй на кратную (двайную ці трайную) сувязь.
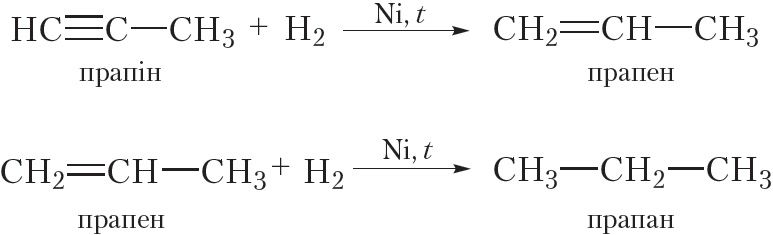
2. Гідрыраванне. Далучэнне вадароду
У выніку гідрыравання алкінаў спачатку ўтвараюцца алкены, а потым алканы. Для працякання рэакцыі неабходны каталізатар (Pt або Ni).
Прывядзём ураўненні рэакцый, якія працякаюць пры гідрыраванні прапіну:
3. Гідрагалагенаванне. Далучэнне галагенавадародаў
Алкіны могуць далучаць малекулы складаных рэчываў. У выніку далучэння малекулы хлоравадароду да малекулы ацэтылену ўтвараецца хлорэтэн:

Вуглевадародны радыкал СH2 ![]() CH
CH ![]() мае трывіяльную назву вініл. Таму хлорэтэн (СH2
мае трывіяльную назву вініл. Таму хлорэтэн (СH2 ![]() CH
CH ![]() Cl) часта называюць вінілхларыдам. Вінілхларыд — бясколерны газ са слабым саладкаватым пахам, вельмі ядавіты, tкіп = –14 °С.
Cl) часта называюць вінілхларыдам. Вінілхларыд — бясколерны газ са слабым саладкаватым пахам, вельмі ядавіты, tкіп = –14 °С.
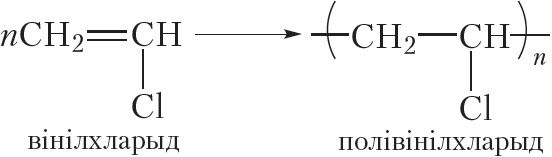
Малекула вінілхларыду змяшчае двайную сувязь, таму ён, падобна алкенам, уступае ў рэакцыю полімерызацыі:
галагенавадародаў
і вады да гамолагаў
ацэтылену
Прадукт рэакцыі полімерызацыі вінілхларыду — полівінілхларыд, або скарочана ПВХ, шырока выкарыстоўваецца для вырабу аконных рам, дзвярэй, лінолеуму, электраізаляцыі правадоў, штучнай скуры і іншых вырабаў.
З асаблівасцямі далучэння галагенавадародаў і вады да гамолагаў ацэтылену вы можаце пазнаёміцца, перайшоўшы па спасылцы ў QR-кодзе.
4. Гарэнне. Узаемадзеянне з кіслародам
Як і ўсе вуглевадароды, алкіны гараць. Ураўненне рэакцыі гарэння ацэтылену:
![]()
Пры гарэнні ацэтылену ў кіслародзе выдзяляецца вялікая колькасць цеплаты, тэмпература полымя настолькі высокая, што ім можна зварваць і рэзаць металы. Таму ацэтыленавае полымя выкарыстоўваецца пры зварцы і рамонце металічных вырабаў.
Атрыманне ацэтылену
1. Карбідны спосаб
Ацэтылен атрымліваюць у выніку дзеяння вады на карбід кальцыю СаС2. Чысты карбід кальцыю ўяўляе сабой цвёрдае белае рэчыва без паху. Тэхнічны прадукт мае шэры колер і непрыемны пах з-за наяўнасці дамешак.
Карбід кальцыю бурна рэагуе з вадой, пры гэтым вылучаецца ацэтылен:
![]()
Для атрымання карбіду кальцыю выкарыстоўваюць вапняк (СаСО3), пры награванні якога ўтвараецца аксід кальцыю. Потым аксід кальцыю спякаюць з вугалем у электрапечы пры тэмпературы прыкладна 2000 °С:

2. Піроліз метану
атрымання алкінаў
Яшчэ адным спосабам атрымання ацэтылену з’яўляецца частковае тэрмічнае раскладанне метану. Вы ўжо ведаеце, што калі алканы нагрэць да высокай тэмпературы (падвергнуць піролізу), то яны раскладаюцца на вуглярод і вадарод (§ 10). Аказваецца, адным з прамежкавых прадуктаў піролізу метану з’яўляецца ацэтылен. Каб прадухіліць раскладанне ацэтылену, які ўтвараецца пры высокай тэмпературы (прыкладна 1500 °С), прадукты рэакцыі хутка ахалоджваюць. Працэс, які працякае, можна паказаць ураўненнем:
![]()
З іншымі метадамі атрымання алкінаў вы можаце пазнаёміцца, перайшоўшы па спасылцы ў QR-кодзе.
Вуглевадароды нецыклічнай будовы, у малекулах якіх маецца адна трайная сувязь, называюцца алкінамі.
Агульная формула алкінаў CnH2n–2.
Трайная сувязь у малекулах алкінаў уключае адну σ- і дзве π-сувязі.
Характэрнымі для алкінаў з’яўляюцца рэакцыі далучэння па трайной сувязі. Пры гэтым адбываецца расшчапленне π-сувязей. Алкіны могуць далучаць галагены, вадарод, галагенавадароды.
Рэакцыі абясколервання раствору перманганату калію і бромнай вады з’яўляюцца якаснымі рэакцыямі на кратную (двайную і трайную) сувязь.
Ацэтылен атрымліваюць дзеяннем вады на карбід кальцыю і піролізам метану.
Алкіны ізамерны алкадыенам.
*Далучэнне галагенавадародаў і вады да гамолагаў ацэтылену
Гамолагі ацэтылену далучаюць галагенавадароды і ваду ў адпаведнасці з правілам Маркоўнікава, гэта значыць вадарод далучаецца да больш гідрагенізаванага атама вугляроду трайной сувязі.
Далучэнне галагенавадародаў. Гідрагалагенаванне
Прывядзём ураўненне рэакцыі далучэння хлоравадароду да прапіну:

Далучэнне вады. Гідратацыя
Далучэнне вады да ацэтылену адбываецца ў прысутнасці солей ртуці і сернай кіслаты. Пры гэтым утвараецца воцатны альдэгід:

Гэта рэакцыя носіць імя рускага хіміка Міхаіла Рыгоравіча Кучарава.
Разгледзім падрабязней, як працякае дадзеная рэакцыя. Спачатку малекула вады далучаецца па адной π-сувязі малекулы ацэтылену. Пры гэтым утвараецца няўстойлівы вінілавы спірт:

Спірты, у якіх гідраксільная група знаходзіцца пры двайной сувязі C ![]() C, няўстойлівыя, таму вінілавы спірт адразу ж ператвараецца ў воцатны альдэгід:
C, няўстойлівыя, таму вінілавы спірт адразу ж ператвараецца ў воцатны альдэгід:

Цяпер разгледзім далучэнне вады да прапіну. Рэакцыя працякае ў адпаведнасці з правілам Маркоўнікава, таму ў дадзеным выпадку ўтвараецца кетон. Далучэнне вады да прапіну:

*Метады атрымання алкінаў
Дэгідрагалагенаванне дыгалагенвытворных алканаў
Ацэтылен можна атрымаць дэгідрагалагенаваннем 1,2-дыбромэтану спіртавым растворам шчолачы:

Як бачна, ад адной малекулы дыгалагенвытворнага адшчапляюцца дзве малекулы бромавадароду, у выніку ўтвараецца ацэтылен.
Ці можна атрымаць ацэтылен уздзеяннем спіртавога раствору шчолачы на 1,1-дыбромэтан?
Пытанні і заданні
1. Адлюструйце шарастрыжнёвую мадэль малекулы бутыну-2. Укажыце тыпы гібрыдызацыі атамаў вугляроду ў дадзенай малекуле і валентныя вуглы. Ці можа бутын-2 існаваць у выглядзе прасторавых цыс- і транс-ізамераў?
2. Ці існуе вуглевадарод разгалінаванай будовы, які змяшчае ў малекуле чатыры атамы вугляроду і: а) двайную сувязь; б) трайную сувязь?
3. Напішыце структурныя формулы ізамерных алкінаў саставу С5Н8. Дайце ім назвы.
* Напішыце структурныя формулы міжкласавых ізамераў такога самага саставу.

4. Напішыце ўраўненне рэакцыі далучэння адной малекулы брому да малекулы бутыну-2. Назавіце прадукт рэакцыі.
5. У выніку няпоўнага гідрыравання алкіну атрымліваецца алкен, пры ўзаемадзеянні якога з бромнай вадой утвараецца дыбромвытворнае алкану саставу C4Н8Br2, малекула якога мае сіметрычную будову. Прывядзіце структурную формулу алкіну і алкену, а таксама ўраўненні ўсіх рэакцый, якія працякаюць.
6. Пры ажыццяўленні зварачных работ для атрымання ацэтылену з карбіду кальцыю выкарыстоўваюцца генератары ацэтылену, адзін з якіх паказаны на малюнку. Які аб’ём ацэтылену (дм3, н. у.) можна атрымаць з 3 кг тэхнічнага карбіду кальцыю, які змяшчае 22 % дамешак?
7*. Газападобны вуглевадарод аб’ёмам 400 мл (н. у.) змяшалі з кіслародам аб’ёмам 1000 мл (н. у.) і падпалілі. Рэчывы прарэагавалі поўнасцю, і ўтварыўся вуглякіслы газ аб’ёмам 800 мл (н. у.) і вада. Вызначце формулу вуглевадароду.
(Адказ: ацэтылен.)

