§ 7. Прасторавая будова малекул алканаў. sp3‑Гібрыдызацыя
Прасторавая будова малекул алканаў. sp3-Гібрыдызацыя
У папярэднім параграфе мы разгледзелі структурныя формулы некаторых алканаў. Структурныя формулы адлюстроўваюць не толькі састаў, але і паслядоўнасць злучэння атамаў у малекуле. У той жа час структурныя формулы могуць не паказваць прасторавай будовы малекулы.
Напрыклад, структурную формулу метану часта адлюстроўваюць наступным чынам:
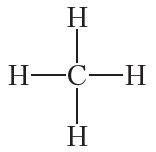
Эксперыментальна ўстаноўлена, што малекула метану не з’яўляецца плоскай, а мае форму правільнага тэтраэдра, у цэнтры якога знаходзіцца атам вугляроду, а ў вяршынях — атамы вадароду:

Вугал паміж сувязямі (валентны вугал) у малекуле метану роўны 109°28′.
У структурнай формуле метану сувязі часта адлюстроўваюць пад вуглом 90°. Магчымы і іншыя варыянты, напрыклад:
Усе гэтыя варыянты структурных формул з’яўляюцца правільнымі, так як дакладна адлюстроўваюць паслядоўнасць злучэння атамаў у малекуле.
Разгледзім будову малекулы метану больш падрабязна. Утварэнне сувязей у малекулах адбываецца ў выніку перакрывання атамных арбіталей. Будову электроннай абалонкі атама вугляроду ва ўзбуджаным стане паказвае электронна-графічная схема:
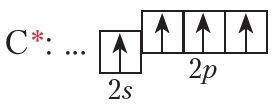
Ва ўзбуджаным стане ў атама вугляроду маецца адзін электрон на s-арбіталі і тры электроны на р-арбіталях. Пры ўтварэнні кавалентных сувязей з атамамі вадароду магчымы два спосабы перакрывання электронных воблакаў (мал. 7.2 і 7.3).
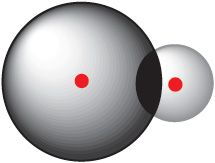
2s-воблака атама вугляроду
і 1s-воблака атама вадароду
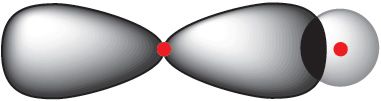
2р-воблака атама вугляроду
і 1s-воблака атама вадароду
Сувязь, утвораная ў выніку перакрывання 2s-арбіталі атама вугляроду і 1s-арбіталі атама вадароду (мал. 7.2), павінна адрознівацца ад трох іншых сувязей, якія ўтвараюцца ў выніку перакрывання 2p-арбіталей атама вугляроду і 1s-арбіталі атама вадароду (мал. 7.3). У рэчаіснасці ўсе чатыры сувязі ў малекуле метану цалкам аднолькавыя. Для тлумачэння гэтага факту выкарыстоўваюцца ўяўленні аб гібрыдызацыі атамных арбіталей.
Пры ўтварэнні кавалентных сувязей у малекуле метану чатыры валентныя арбіталі атама вугляроду змешваюцца і ўтвараюць чатыры арбіталі аднолькавай формы (гібрыдныя арбіталі):
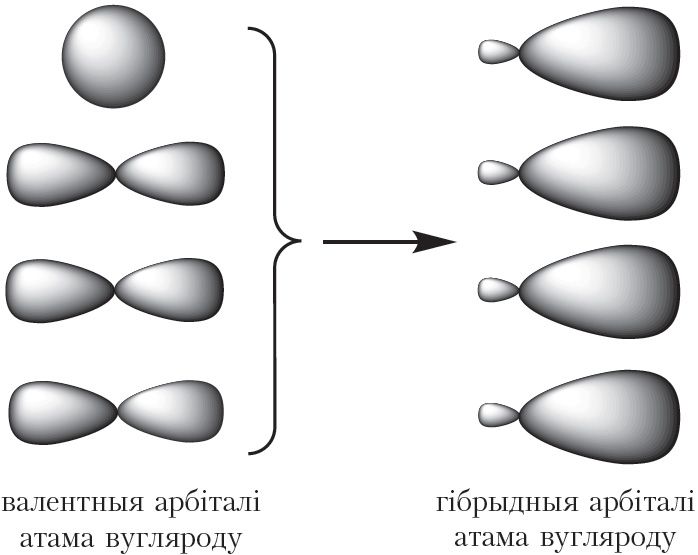
Разгледзім, як размяшчаюцца чатыры гібрыдныя арбіталі атама вугляроду ў прасторы. Электронныя воблакі маюць адмоўны зарад, таму гібрыдныя арбіталі павінны размяшчацца такім чынам, каб электрастатычнае адштурхоўванне аднайменна зараджаных электронаў было найменшым.
Дадзенай умове адпавядае размяшчэнне гібрыдных арбіталей пад вуглом 109°28′ (мал. 7.5).
Гэтыя вывады пацвярджаюцца вынікамі даследавання з дапамогай фізікахімічных метадаў. Сапраўды, малекула метану мае тэтраэдрычную форму, вугал паміж сувязямі С ![]() Н складае 109°28′ (мал. 7.6).
Н складае 109°28′ (мал. 7.6).
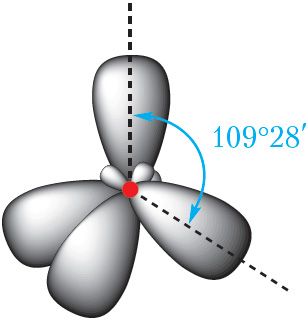
sp3-гібрыдызаванага
атама вугляроду
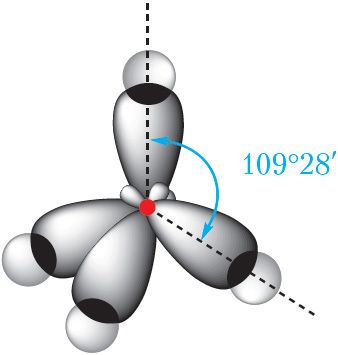
воблакаў атама вугляроду і чатырох
атамаў вадароду ў малекуле метану
Са схемы перакрывання электронных воблакаў у малекуле метану відаць, што гібрыдныя электронныя воблакі атама вугляроду выцягнуты да атама вадароду. Такія воблакі могуць мацней перакрывацца з электроннымі воблакамі атамаў вадароду і, такім чынам, утвараць больш трывалыя сувязі.
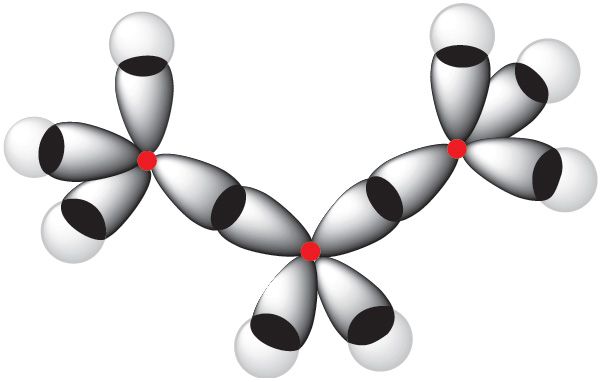
воблакаў у малекуле прапану С3Н8
У sp3-гібрыдызацыі ўдзельнічаюць чатыры арбіталі атама вугляроду — адна s- і тры p- арбіталі. sp3-Гібрыдныя арбіталі размяшчаюцца ў прасторы пад вуглом 109°28′.
Малекулы іншых алканаў, таксама як і малекула метану, пабудаваны з <em>sp3-гібрыдызаваных атамаў вугляроду. Кожны sp3-гібрыдызаваны атам вугляроду ўтварае чатыры кавалентныя сувязі. Вугал паміж гэтымі сувязямі (валентны вугал) прыблізна роўны 109° (мал. 7.7).
Прасторавую будову малекул арганічных злучэнняў можна наглядна адлюстраваць з дапамогай шарастрыжнёвых мадэлей. Мадэлямі атамаў вугляроду з’яўляюцца шарыкі шэрага колеру з чатырма адтулінамі; мадэлямі атамаў вадароду — шарыкі белага колеру з адной адтулінай. Мадэлі кавалентных хімічных сувязей — пластмасавыя стрыжні. На малюнку 7.8 паказаны шарастрыжнёвыя мадэлі малекул метану, прапану і н-бутану.
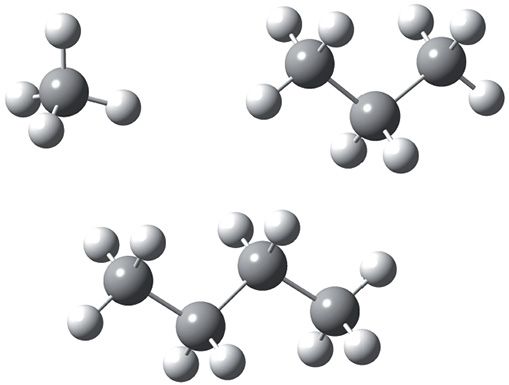
Бачна, што атамы вугляроду ў малекулах прапану і н-бутану не ляжаць на адной прамой. Напрыклад, вугляродны ланцуг малекулы н-бутану мае форму ломанай лініі. Гэта тлумачыцца тым, што вугал паміж сувязямі C ![]() C
C ![]() C у малекулах алканаў прыблізна роўны 109°.
C у малекулах алканаў прыблізна роўны 109°.
Для адлюстравання структуры алканаў і іншых арганічных рэчываў часта выкарыстоўваюць формулы, у якіх наогул не паказваюцца хімічныя сімвалы вугляроду і вадароду. Формулы алканаў у гэтым выпадку ўяўляюць сабой ломаныя лініі, якія адлюстроўваюць вугляродны шкілет малекулы. Такія формулы называюцца шкілетнымі формуламі. Відавочна, што шкілетныя формулы можна запісваць для алканаў пачынаючы з этану, пры гэтым формула этану мае выгляд рысачкі, а формула прапану ўяўляе сабой ломаную лінію, якая складаецца з двух прамых, і г. д.:
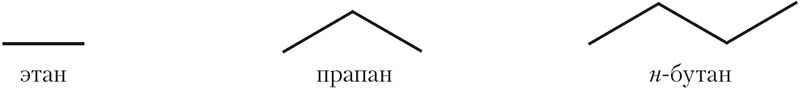
Шкілетныя формулы арганічных злучэнняў шырока выкарыстоўваюцца разам са звычайнымі структурнымі формуламі. Перавага дадзеных формул — кампактнасць і хуткасць напісання. Акрамя гэтага, шкілетныя формулы, у адрозненне ад звычайных структурных формул, даюць уяўленне аб прасторавай будове малекул арганічных злучэнняў.
Малекулы алканаў пабудаваны з sp3-гібрыдызаваных атамаў вугляроду.
Кожны sp3-гібрыдызаваны атам вугляроду ўтварае чатыры кавалентныя сувязі. Вугал паміж гэтымі сувязямі прыблізна роўны 109°.
Вугляродны ланцуг малекул алканаў мае форму ломанай лініі.