§ 3. Типы химической связи
Типы химической связи
Из курса химии 7–9-го классов вы знаете, что при обычных условиях атомы большинства химических элементов в свободном виде (по отдельности) не существуют. Даже в простых веществах атомы связаны друг с другом химическими связями. Исключением являются лишь благородные газы.
Например, простое вещество водород состоит из молекул Н2, в которых два атома водорода связаны одной ковалентной связью: ![]() .
.
| Химическая связь — взаимодействие, связывающее отдельные атомы в химические соединения (молекулы или кристаллы). |
Участвовать в образовании химических связей могут только те электроны, которые слабее всего связаны с ядром, то есть электроны внешнего энергетического уровня. Такие электроны называются валентными.
Валентные электроны принято обозначать точками, которые окружают символ химического элемента. Такие формулы называются электронными формулами.
![]()
электронные формулы атомов водорода и углерода
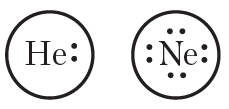
Окружность вокруг электронной формулы указывает на завершённость внешнего слоя. То есть атом гелия имеет завершённую двухэлектронную, а атом неона — восьмиэлектронную внешнюю оболочку. Отсюда следует важный вывод — атомы будут стремиться сформировать стабильные завершённые электронные оболочки за счёт отдачи, присоединения либо обобществления электронов. При этом образуются химические связи.
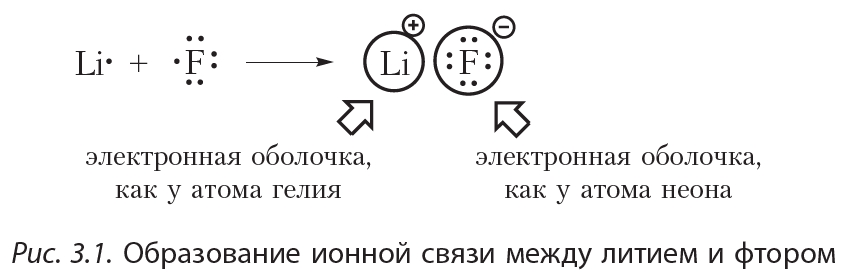
Пример 1. Образование ионной связи между литием и фтором.
На внешнем электронном слое атома лития находится один электрон, поэтому атом лития легко отдаёт этот электрон, приобретая завершённую электронную оболочку, как у ближайшего благородного газа — гелия. На внешнем слое атома фтора располагается семь электронов, поэтому фтор, наоборот, легко присоединяет один электрон, приобретая завершённую восьмиэлектронную внешнюю оболочку, как у атома неона:
При образовании фторида лития электрон от атома лития переходит к атому фтора. В результате образуются ионы Li+ и F–. Электронные конфигурации ионов Li+ и F– такие же, как у атомов гелия и неона соответственно:
Li+: 1s2
F–: …2s23p6
Разноимённо заряженные ионы притягиваются друг к другу. Такая связь называется ионной. Ионная связь образуется между атомами металла и неметалла. Ионная связь имеется в солях (NaCl, KF), оксидах металлов (Na2O, K2O), гидроксидах металлов (NaOH, KOH).
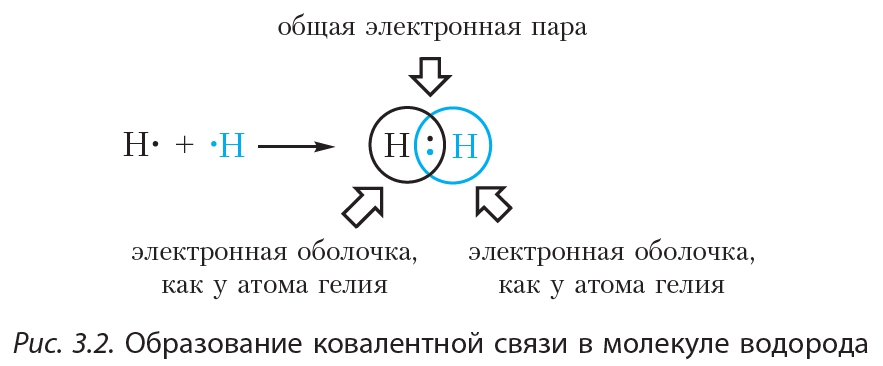
Пример 2. Образование ковалентной связи в молекуле водорода H2.
На внешнем слое атома водорода имеется один неспаренный электрон. Поскольку при образовании молекулы водорода между собой взаимодействуют одинаковые атомы, электрон не будет переходить от одного атома к другому и разноимённо заряженные ионы образовываться не будут. Вместо этого неспаренные электроны двух атомов водорода образуют общую электронную пару. При этом каждый атом водорода приобретает завершённую электронную оболочку, как у атома гелия:
Связь, образованную посредством общих электронных пар, называют ковалентной. В формулах ковалентную связь (общую электронную пару) обозначают чёрточкой. Например, формулу молекулы водорода можно записать ![]() . Такая формула называется структурной. Она показывает не только состав, но и строение молекулы.
. Такая формула называется структурной. Она показывает не только состав, но и строение молекулы.
Ковалентная связь образуется между атомами неметаллов. Ковалентная связь имеется в простых веществах неметаллов (H2, Cl2, O2, N2), оксидах неметаллов (CO2, SO2), кислотах (HCl, H2SO4).
Мы рассмотрели два типа химической связи — ковалентную и ионную. Ковалентная связь образуется между атомами неметаллов. Посредством ионной связи соединяются металлы с неметаллами.
При взаимодействии атомов металлов друг с другом возникает третий тип химической связи — металлическая связь. Подробно с этим типом связи вы знакомились в курсе химии 9-го класса. Напомним, что металлическая связь имеется в простых веществах, образованных металлами, например Na, K, Fe, и в металлических сплавах.
|
Существует три типа химической связи: ковалентная, ионная и металлическая. Ковалентная связь образуется между атомами неметаллов в простых веществах (H2, F2, O2), оксидах неметаллов (H2O, CO2), кислотах (HF, HCl, H2SO4, HNO3). Ионная связь образуется между атомами металла и неметалла в солях (NaCl, KF), оксидах металлов (K2O, BaO), гидроксидах металлов (NaOH, KOH). Металлическая связь образуется между атомами металлов в простых веществах (Na, K, Cu) и металлических сплавах. |