§ 42. Вугальная і крэмніевая кіслоты, іх солі
Вугальная кіслата і яе солі
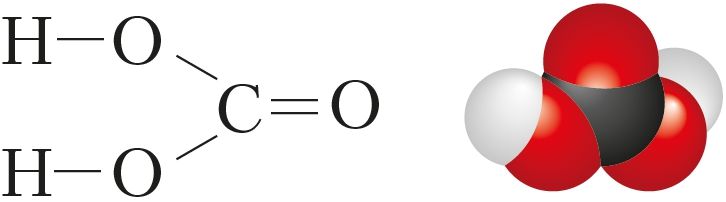
Вугальная кіслата H2CO3 з’яўляецца двухасноўнай і адносіцца да слабых кіслот (мал. 100). У свабодным стане ў выглядзе крышталёў яна вылучана пры тэмпературы ніжэйшай за –30 °С толькі ў другім дзесяцігоддзі XXI стагоддзя.
У водным растворы вугальная кіслата дысацыіруе ступеньчата:
У звычайных умовах яна распадаецца на вуглякіслы газ і ваду:
.
Вугальнай кіслаце адпавядаюць два рады солей: карбанаты (сярэднія) і гідракарбанаты (кіслыя). Адзначым дзве найважнейшыя ўласцівасці солей вугальнай кіслаты.
1. Узаемадзеянне з кіслотамі. Агульнай уласцівасцю карбанатаў і гідракарбанатаў з’яўляецца «закіпанне» пры дзеянні больш моцных кіслот як на цвёрдую соль, так і на яе раствор. Адбываецца вылучэнне газу без колеру і паху:

Узаемадзеянне солей з моцнымі кіслотамі выкарыстоўваюць як тэст (якасную рэакцыю) на прысутнасць солей вугальнай кіслаты — карбанатаў і гідракарбанатаў (Дадатак 3).
Акрамя таго, такія рэакцыі могуць выкарыстоўвацца для атрымання вуглякіслага газу ў лабараторыі, напрыклад, з мармуру CaCO3:
.
2. Тэрмічнае раскладанне. Другая асаблівасць солей вугальнай кіслаты — іх невысокая тэрмічная ўстойлівасць (акрамя карбанатаў натрыю і калію, рубідыю і цэзію). Пры награванні яны раскладаюцца:
Аналізуючы сказанае і ўраўненні хімічных рэакцый папярэдняга параграфа, можна зрабіць вывад, што карбанаты і гідракарбанаты здольныя да ўзаемаператварэнняў, якія ўмоўна можна паказаць схемай:
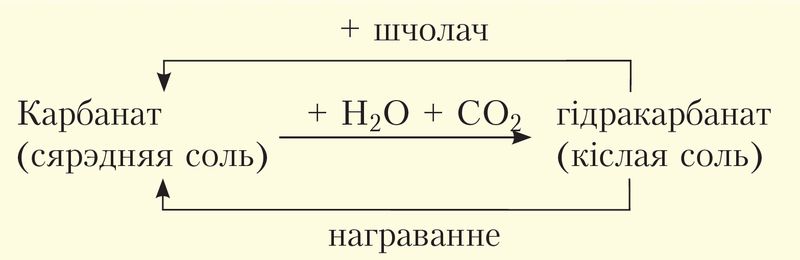
На прыкладзе карбанату кальцыю ўраўненні рэакцый, адпаведныя дадзенай схеме, выглядаюць так:
Карбанаты і гідракарбанаты знаходзяць шырокае прымяненне ў будаўніцтве, побыце, оптыцы, медыцыне, а таксама ў вытворчасці мыла, шкла, паперы, з’яўляюцца напаўняльнікамі вогнетушыльнікаў.
Табліца 30.1. Выкарыстанне солей вугальнай кіслаты
| Хімічная формула і сістэматычная назва | Трывіяльная назва, прыродныя мінералы | Сферы выкарыстання |
| Na2СO3 Карбанат натрыю |
Кальцынаваная сода | Вытворчасць мыйных сродкаў, шкла, фарбавальнікаў; цэлюлозна-папяровая, тэкстыльная, нафтахімічная прамысловасць |
| Na2СO3 ∙ 10H2O Дэкагідрат карбанату натрыю |
Крышталічная сода — мінерал | |
| NaHCO3 Карбанат кальцыю |
Пітная сода | Кулінарыя, дэзынфекцыя поласці рота, сродак ад пякоткі. Пажаратушэнне. Бяспечнае мыццё посуду |
| СаСО3 Карбонат кальция |
Мел — горная парода | Пабелка, вытворчасць шкла, гумы |
| Кальцыт — мінерал | Хімічная вытворчасць, будаўніцтва, оптыка, вырабны камень | |
| Ракушачнік — горная парода | Будаўнічы матэрыял | |
| Вапняк — горная парода | Абліцавальны і архітэктурна-будаўнічы матэрыял | |
| Мармур — горная парода | Абліцавальны і архітэктурна-будаўнічы матэрыял | |
| Жэмчуг — каштоўны камень біялагічнага паходжання, які ўтвараецца ў ракавінах некаторых малюскаў | Ювелірныя вырабы | |
| (СuOH)2CO3 Карбанат гідраксамедзі(II) |
Малахіт — мінерал | Вырабны камень. Раней — для здабычы медзі |
| MgСO3 Карбанат магнію |
Магнезіт — мінерал | Вытворчасць вогнетрывалых матэрыялаў |
| CaMg(CO3)2 Двайны карбанат кальцыю і магнію |
Даламіт — мінерал | Выраб цэменту, тынкоўкі, вогнетрывалых матэрыялаў, у шкляной прамысловасці, у сельскай гаспадарцы для раскіслення глебы |