§ 42. Вугальная і крэмніевая кіслоты, іх солі
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 42. Вугальная і крэмніевая кіслоты, іх солі |
| Напечатано:: | Гость |
| Дата: | Вторник, 12 Август 2025, 12:48 |
Вугальная кіслата і яе солі
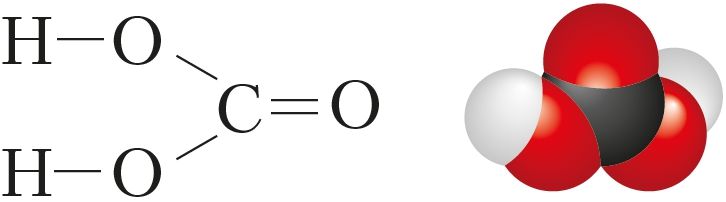
Вугальная кіслата H2CO3 з’яўляецца двухасноўнай і адносіцца да слабых кіслот (мал. 100). У свабодным стане ў выглядзе крышталёў яна вылучана пры тэмпературы ніжэйшай за –30 °С толькі ў другім дзесяцігоддзі XXI стагоддзя.
У водным растворы вугальная кіслата дысацыіруе ступеньчата:
У звычайных умовах яна распадаецца на вуглякіслы газ і ваду:
.
Вугальнай кіслаце адпавядаюць два рады солей: карбанаты (сярэднія) і гідракарбанаты (кіслыя). Адзначым дзве найважнейшыя ўласцівасці солей вугальнай кіслаты.
1. Узаемадзеянне з кіслотамі. Агульнай уласцівасцю карбанатаў і гідракарбанатаў з’яўляецца «закіпанне» пры дзеянні больш моцных кіслот як на цвёрдую соль, так і на яе раствор. Адбываецца вылучэнне газу без колеру і паху:

Узаемадзеянне солей з моцнымі кіслотамі выкарыстоўваюць як тэст (якасную рэакцыю) на прысутнасць солей вугальнай кіслаты — карбанатаў і гідракарбанатаў (Дадатак 3).
Акрамя таго, такія рэакцыі могуць выкарыстоўвацца для атрымання вуглякіслага газу ў лабараторыі, напрыклад, з мармуру CaCO3:
.
2. Тэрмічнае раскладанне. Другая асаблівасць солей вугальнай кіслаты — іх невысокая тэрмічная ўстойлівасць (акрамя карбанатаў натрыю і калію, рубідыю і цэзію). Пры награванні яны раскладаюцца:
Аналізуючы сказанае і ўраўненні хімічных рэакцый папярэдняга параграфа, можна зрабіць вывад, што карбанаты і гідракарбанаты здольныя да ўзаемаператварэнняў, якія ўмоўна можна паказаць схемай:
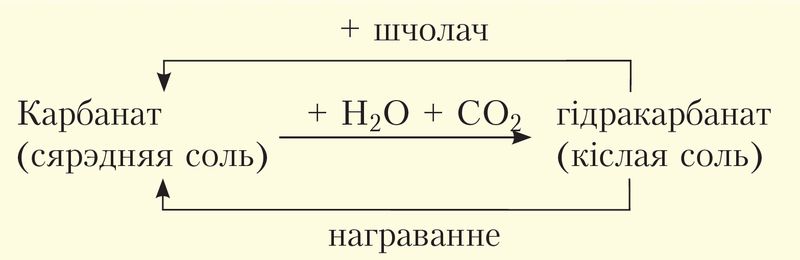
На прыкладзе карбанату кальцыю ўраўненні рэакцый, адпаведныя дадзенай схеме, выглядаюць так:
Карбанаты і гідракарбанаты знаходзяць шырокае прымяненне ў будаўніцтве, побыце, оптыцы, медыцыне, а таксама ў вытворчасці мыла, шкла, паперы, з’яўляюцца напаўняльнікамі вогнетушыльнікаў.
Табліца 30.1. Выкарыстанне солей вугальнай кіслаты
| Хімічная формула і сістэматычная назва | Трывіяльная назва, прыродныя мінералы | Сферы выкарыстання |
| Na2СO3 Карбанат натрыю |
Кальцынаваная сода | Вытворчасць мыйных сродкаў, шкла, фарбавальнікаў; цэлюлозна-папяровая, тэкстыльная, нафтахімічная прамысловасць |
| Na2СO3 ∙ 10H2O Дэкагідрат карбанату натрыю |
Крышталічная сода — мінерал | |
| NaHCO3 Карбанат кальцыю |
Пітная сода | Кулінарыя, дэзынфекцыя поласці рота, сродак ад пякоткі. Пажаратушэнне. Бяспечнае мыццё посуду |
| СаСО3 Карбонат кальция |
Мел — горная парода | Пабелка, вытворчасць шкла, гумы |
| Кальцыт — мінерал | Хімічная вытворчасць, будаўніцтва, оптыка, вырабны камень | |
| Ракушачнік — горная парода | Будаўнічы матэрыял | |
| Вапняк — горная парода | Абліцавальны і архітэктурна-будаўнічы матэрыял | |
| Мармур — горная парода | Абліцавальны і архітэктурна-будаўнічы матэрыял | |
| Жэмчуг — каштоўны камень біялагічнага паходжання, які ўтвараецца ў ракавінах некаторых малюскаў | Ювелірныя вырабы | |
| (СuOH)2CO3 Карбанат гідраксамедзі(II) |
Малахіт — мінерал | Вырабны камень. Раней — для здабычы медзі |
| MgСO3 Карбанат магнію |
Магнезіт — мінерал | Вытворчасць вогнетрывалых матэрыялаў |
| CaMg(CO3)2 Двайны карбанат кальцыю і магнію |
Даламіт — мінерал | Выраб цэменту, тынкоўкі, вогнетрывалых матэрыялаў, у шкляной прамысловасці, у сельскай гаспадарцы для раскіслення глебы |
Крэмніевая кіслата і яе солі
Крэмніевая кіслата H2SiO3 з’яўляецца двухасноўнай і больш слабай, чым вугальная кіслата. Яе атрымліваюць узаемадзеяннем сілікатаў (Na2SiO3 або K2SiO3) з больш моцнай кіслатой, напрыклад H2SO4, HCl:
Крэмніевая кіслата пры гэтым вылучаецца ў выглядзе студзяністага асадку, састаў якога часта паказваюць формулай nSiO2 · mH2O. У сапраўднасці крэмніевая кіслата мае палімерную прыроду:
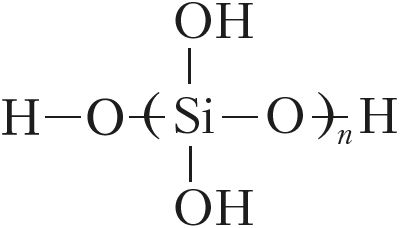
Ужо пры нязначным награванні або доўгім захоўванні кіслата раскладаецца на аксід і ваду:
.
Утвораны аксід SiO2 мае порыстую структуру і вялікую плошчу паверхні (да 1000 м2/г), што дазваляе яму абсарбіраваць малекулы розных рэчываў, у тым ліку і ваду. Менавіта дзякуючы абсарбцыйным уласцівасцям аксід SiO2 пад назвай «сілікагель» выкарыстоўваецца як асушальнік паветра ва ўпакоўках з электронікай і абуткам, а пад назвай «Белы вугаль» — як абсарбент у медыцыне (мал. 101).

Солі крэмніевай кіслаты
Для крэмніевай кіслаты вядомыя толькі сярэднія солі — сілікаты. Большасць з іх дрэнна раствараецца ў вадзе. Растваральныя солі сілікат натрыю і сілікат калію называюць «растваральнае шкло» і выкарыстоўваюць як «канцылярскі клей». Атрымаць сілікаты можна сплаўленнем аксіду крэмнію(IV) як кіслотнага аксіду са шчолачамі, аксідамі металаў, а таксама з карбанатамі:
Вытворчасць будаўнічых матэрыялаў на аснове сілікатаў і карбанатаў
Прыродныя сілікаты і карбанаты служаць асновай для вытворчасці цэменту, бетону, шкла.
Цэмент атрымліваюць спяканнем вапняку CaCO3 і гліны, адна з састаўных частак якой — каалініт, які ўключае аксіды SiO2 і Al2O3.
У працэсе спякання сумесі вапняку СаСО3 і каалініту Al2[Si2O5](OH)4 утвараецца складаная сумесь бязводных солей — сілікатаў і алюмінатаў кальцыю. Нагадаем, што пры змешванні такой тонка здробненай сумесі з вадой адбываецца гідратацыя, утварэнне крышталегідратаў, зрастанне асобных часцінак адна з адной (схопліванне) і атрыманне цвёрдага трывалага матэрыялу — цэментавага каменю.
Бетон вырабляюць з сумесі пяску, цэменту і вады. Дадаючы ў такую сумесь шлак, атрымліваюць шлакабетон. Калі свежапрыгатаванай сумессю заліваюць металічны каркас, то пры зацвярдзенні атрымліваюцца жалезабетонныя канструкцыі. Пры выкарыстанні ў якасці напаўняльніку газападобных рэчываў атрымліваюць пенабетон.
Шкло ўжываюць у будаўнічай сферы (шкленне вокнаў, вітражоў, дзвярэй, аранжарэй), у аптычнай прамысловасці, медыцыне, машынабудаванні, прыборабудаванні, сучаснай архітэктуры, электроніцы, побыце. Як адзначана вышэй у параграфе, сыравіна для вытворчасці шкла («варэння шкла») — карбанаты натрыю і кальцыю, а таксама аксід крэмнію(IV), гэта значыць крышталічная сода, мел або вапняк і кварцавы пясок (Na2CO3, CaCO3, SiO2). Як ужо адзначалася ў § 41, у састаў шкла ўваходзяць аксіды натрыю, кальцыю і крэмнію ў мольных суадносінах 1 : 1 : 6.
Для надання шклу асаблівых уласцівасцей у зыходную сумесь уводзяць дабаўкі. Так, для яго афарбоўвання выкарыстоўваюць розныя аксіды: СuO надае блакітны колер, FeO — зялёны, СоO — ад блакітнага да сіне-фіялетавага. Глушыцелі памяншаюць празрыстасць шкла, робяць яго матавым. Наклейванне палімерных плёнак павялічвае трываласць. Арміраванне металічным дротам надае дэкаратыўныя ўласцівасці і перашкаджае ўтварэнню вялікіх асколкаў пры растрэскванні. Варта адзначыць магчымасць шматразовай перапрацоўкі шкла.
Крэмніевая і вугальная кіслоты — няўстойлівыя рэчывы, што раскладаюцца з утварэннем аксіду і вады: крэмніевая — пры нязначным награванні або доўгім захоўванні, а вугальная — адразу пры ўтварэнні.
Карбанаты і гідракарбанаты здольныя да ўзаемаператварэнняў.
Найважнейшымі будаўнічымі матэрыяламі на аснове прыродных сілікатаў і карбанатаў з’яўляюцца цэмент, бетон і шкло.
Пытанні, заданні, задачы
1. Выпішыце характарыстыкі, якія адносяцца
- а) да вугальнай кіслаты;
- б) да крэмніевай кіслаты:
- 1) слабы электраліт;
- 2) тэрмічна ўстойлівая;
- 3) раскладаецца на аксід і ваду;
- 4) утвараецца пры растварэнні аксіду ў вадзе;
- 5) пры раскладанні ўтварае газападобны аксід;
- 6) прадукт яе распаду — сілікагель;
- 7) утварае два рады солей;
- 8) яе солі пры дадаванні кіслаты «закіпаюць»;
- 9) солі называюць карбанатамі і гідракарбанатамі;
- 10) утвараецца пры дадаванні салянай кіслаты да сілікатаў;
- 11) солі называюць сілікатамі;
- 12) адзін з атамаў мае ступень акіслення +4.
2. Запішыце ў малекулярнай і іоннай форме ўраўненні рэакцый, якія ілюструюць хімічныя ўласцівасці а) вугальнай і б) крэмніевай кіслот, названыя ў заданні 1.
3. Запоўніце табліцу «Будаўнічыя матэрыялы» (цэмент, бетон, жалезабетон, шкло).
| Будаўнічы матэрыял | Сыравіна для вытворчасці |
4. Запоўніце табліцу «Прымяненне карбанатаў і гідракарбанатаў».
| № | Хімічныя формулы і назвы | Сферы выкарыстання |
5. Складзіце ўраўненні магчымых рэакцый:
- a)
- б)
- в)
- г)
- д)
- е)
- ж)
- з)
- i)
- к)
- л)
- м)
6. Разлічыце масы кальцыніраванай соды, вапняку і кварцавага пяску, неабходныя для атрымання шкла масай 100 кг, дапускаючы, што зыходныя рэчывы не ўтрымліваюць прымесей.
7. Складзіце ўраўненні рэакцый паводле схемы:

8. Пры доўгім захоўванні раствораў шчолачаў у шкляным посудзе ў растворах узнікае муць. Патлумачце, якія рэакцыі з’яўляюцца прычынай гэтай з’явы.
9. Прапануйце спосабы атрымання не менш як васьмі складаных рэчываў, маючы ў распараджэнні сілікат калію і гідракарбанат кальцыю. Запішыце ўраўненні рэакцый і спіс атрыманых рэчываў.
10. Вызначце аб’ём вуглякіслага газу (н. у.), што вылучыцца з вогнетушыльніка, які ўтрымлівае серную кіслату і раствор аб’ёмам 10 дм3 з масавай доляй гідракарбанату натрыю 8 % (шчыльнасць раствору — 1,058 г/см3).
*Падрыхтуйце паведамленні:
- 1. Як утвараюцца сталактыты і сталагміты;
- 2. Вытворчасць шкла ў Рэспубліцы Беларусь.
*Самакантроль
1. Вугальная кіслата ўтварае солі:
- а) сілікаты;
- б) карбіды;
- в) карбанаты;
- г) гідракарбанаты.
2. Асноўнай сыравінай для вытворчасці шкла з’яўляюцца:
- а) вапняк;
- б) гліна;
- в) кальцынаваная сода;
- г) кварцавы пясок.
3. Соль саставу Са(НСО3)2:
- а) з’яўляецца кіслай;
- б) рэагуе з вуглякіслым газам у растворы;
- в) тэрмічна няўстойлівая;
- г) рэагуе са шчолачамі.
4. Тэрмічна ўстойлівым рэчывам з’яўляецца:
- а) SiO2;
- б) Ca(НСO3)2;
- в) H2SiO3;
- г) H2СO3.
5. Не працякае рэакцыя:
- а) СаСО3
;
- б) K2СO3
;
- в) MgO + SiO2
;
- г) Вa(НСO3)2
.