§ 17. Міжмалекулярнае ўзаемадзеянне і вадародная сувязь
Міжмалекулярнае ўзаемадзеянне
Рэчывы малекулярнай будовы могуць існаваць у трох агрэгатных станах — цвёрдым, вадкім і газападобным. Але тэмпературныя ўмовы таго ці іншага стану для кожнага з рэчываў індывідуальныя.
Прычына тут адна — адрозненне ў сіле ўзаемадзеяння паміж малекуламі. Гэта ўзаемадзеянне называюць міжмалекулярным. Як і хімічная сувязь, міжмалекулярнае ўзаемадзеянне ажыццяўляецца за кошт сіл электрастатычнага прыцяжэння, але ў дзясяткі і сотні разоў больш слабых. Чым мацнейшае міжмалекулярнае ўзаемадзеянне ў рэчыве, тым вышэйшыя яго тэмпературы плаўлення і кіпення. Сіла міжмалекулярнага ўзаемадзеяння — індывідуальная характарыстыка рэчыва, яна залежыць ад электроннай будовы яго малекул.
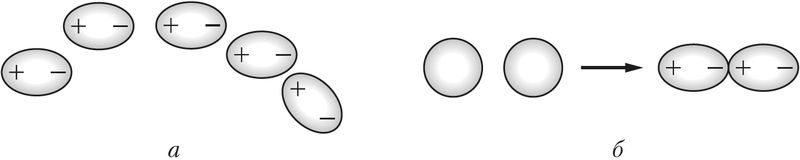
Малекула ў цэлым з’яўляецца электранейтральнай часціцай, але ўнутры малекулы знаходзяцца дадатна зараджаныя ядры, акружаныя электронамі. У залежнасці ад палярнасці і накіраванасці хімічных сувязей унутры малекулы на атамах могуць узнікаць зарады. Так, у малекуле HCl сувязь паміж атамамі палярная і агульная электронная пара зрушана да больш электраадмоўнага атама хлору. У выніку ў адной частцы малекулы — на атаме хлору — узнікае частковы адмоўны зарад, у другой — на атаме вадароду — частковы дадатны зарад. Утвараюцца дыполі . Паміж імі ўзнікае электрастатычнае прыцяжэнне (мал. 40, а; 41, а).
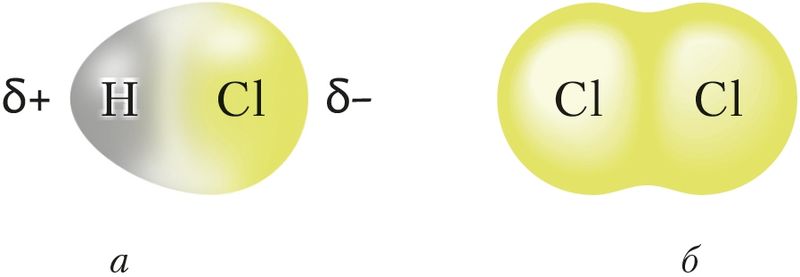
Слабае электрастатычнае прыцяжэнне існуе і паміж непалярнымі малекуламі, напрыклад хлору. Яно тлумачыцца ўтварэннем імгненных дыполяў у выніку руху электронаў у атамах, якія належаць суседнім малекулам (мал. 40, б; 41, б).
Варта мець на ўвазе, што малекулы з палярнымі сувязямі могуць быць у цэлым непалярнымі, гэта значыць не ўяўляць сабой дыполі. Напрыклад, малекулы маюць лінейную будову. Аднак малекулы вады ўяўляюць сабой дыполі, бо маюць вуглавую будову (мал. 33, с. 81).
Велічыня сіл міжмалекулярнага ўзаемадзеяння залежыць ад памераў малекул. Чым большая малекула, тым лягчэй яе знешнія электроны прыцягваюцца да іншай малекулы і тым больш трывалае міжмалекулярнае ўзаемадзеянне. Гэтым тлумачыцца пераход ад газападобнага (F2, Cl2) да вадкага (Br2) і цвёрдага (I2) станаў рэчыва ў радзе галагенаў. Як вядома, ад фтору да ёду па групе радыус атамаў расце. Адпаведна, растуць і памеры малекул, утвораных імі (табл. 14).
Табліца 14. Характарыстыкі малекул галагенаў
| Рэчыва | Фтор | Хлор | Бром | Ёд |
| Мадэлі малекул і іх памеры | 0,142 нм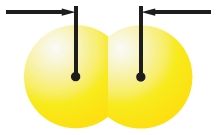 F2 |
0,198 нм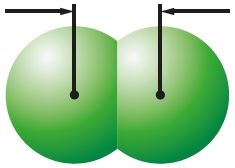 Cl2 |
0,228 нм Br2 |
0,266 нм I2 |
| Тэмпературы кіпення, °C | –188,2 | –34,1 | +58,8 | +184,4 |