§ 6. Ізатэрмічны, ізабарны і ізахорны працэсы
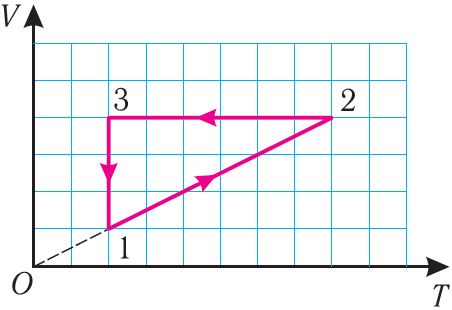
Прыклад 1. На малюнку 28 прыведзены графік трох працэсаў змянення стану пэўнай масы ідэальнага газу. Як змяняліся параметры газу на ўчастках 1 2, 2
3, 3
1? Адлюструйце гэтыя працэсы ў каардынатах (p, V) и (p, T).
Рашэнне. На ўчастку 1 2 аб’ём газу прама прапарцыянальны абсалютнай тэмпературы. Значыць, працэс пераходу газу са стану 1 у стан 2 з’яўляецца ізабарным. З графіка вынікае, што ў стане 2 тэмпература і аб’ём газу ў 4 разы большыя, чым у стане 1. Значыць, у працэсе ізабарнага расшырэння пэўнай масы газу са стану 1 у стан 2 тэмпература і аб’ём газу павялічыліся. Гэта можна запісаць такім чынам:
пераход ,
,
,
,
адбываецца ізабарнае награванне газу.
У працэсе пераходу газу са стану 2 у стан 3 застаецца пастаянным аб’ём (працэс ізахорны), а тэмпература газу памяншаецца ў 4 разы. З суадносін (6.3) вынікае, што пры ізахорным ахаладжэнні ціск газу памяншаецца прапарцыянальна яго абсалютнай тэмпературы. Таму можна запісаць:
пераход ,
,
,
адбываецца ізахорнае ахаладжэнне газу.
Працэс пераходу газу са стану 3 у стан 1 — ізатэрмічны. Пры гэтым аб’ём газу памяншаецца ў 4 разы, што цягне за сабой, згодна з законам Бойля — Марыёта, павелічэнне ціску газу ў 4 разы:
пераход ,
,
адбываецца ізатэрмічнае сцісканне газу.
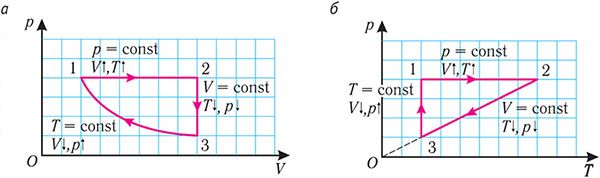
На падставе зробленых высноў адлюструем усе тры працэсы ў каардынатах (p, V) і (p, T) (мал. 29, а, б).
Прыклад 2. Пры ізатэрмічным расшырэнні ідэальнага газу пэўнай масы яго аб’ём павялічыўся ад V1 = 2,0 л да V2 = 5,0 л, а ціск зменшыўся на Δp = –15 кПа. Вызначце першапачатковы ціск газу.
V1 = 2,0 л = 2,0 · 10–3 м3
V2 = 5,0 л = 5,0 · 10–3 м3
Δp = –15 кПа = –1,5 · 104 Па
Рашэнне. Паколькі тэмпература і маса газу не змяняюцца, то яго пачатковы і канчат ковы станы звязаны з законам Бойля — Марыёта, гэта значыць . З улі кам таго, што
, атрымаем:
.
Адсюль .
.
Адказ: .
![]()
Прыклад 3. У дзвюх пасудзінах умяшчальнасцю V1 = 20 л i V2 = 30 л знаходзяцца ідэальныя газы, якія хімічна не рэагуюць. Іх ціскі p1 = 1,0 МПа і p2 = 0,40 МПа адпаведна. Вызначце ціск газаў у пасудзінах пасля таго, як іх злучылі тонкай кароткай трубкай. Тэмпература газаў перад злучэннем і пасля злучэння пасудзін аднолькавая.
V1 = 20 л = 2,0 · 10-2 м3
V2 = 30 л = 3,0 · 10-2 м3
p1 = 1,0 МПа = 1,0 · 106 Па
p2 = 0,40 МПа = 4,0 · 105 Па
T = const
Рашэнне. Ціск сумесі газаў роўны суме парцыяльных ціскаў (закон Дальтана): . Знойдзем парцыяльны ціск кожнага газу пасля злучэння пасудзін. Паколькі тэмпература і масы газаў не змяняюцца, то пачатковы і канчатковы станы кожнага газу звязаны законам Бойля — Марыёта, гэта значыць
,
.
Такім чынам, парцыяльныя ціскі газаў пасля злучэння пасудзін: ,
. Тады
.
Адказ: p = 0,64 МПа.