§ 6. Ізатэрмічны, ізабарны і ізахорны працэсы
| Сайт: | Профильное обучение |
| Курс: | Фізіка. 10 клас |
| Книга: | § 6. Ізатэрмічны, ізабарны і ізахорны працэсы |
| Напечатано:: | Гость |
| Дата: | Воскресенье, 6 Июль 2025, 08:55 |
Уласцівасць газаў істотна змяняць адвезены ім аб’ём шырока выкарыстоўваюць у цеплавых рухавіках. Аналізуючы працэсы, якія адбываюцца з газам у гэтых прыладах, важна ведаць, якім законам падпарадкоўваюцца газы і якія ўмовы прымяняльнасці гэтых законаў.
Працэсы ў газах часта адбываюцца так, што змяняюцца толькі два параметры з пяці (p, V, T, m, M). Калі пры пастаянных масе і малярнай масе яшчэ адзін з макрапараметраў (p, V, T), якія ўваходзяць ва ўраўненне стану ідэальнага газу, не змяняецца, то такія працэсы называюць ізапрацэсамі.
Ізатэрмічны працэс. Працэс змянення стану фізічнай сістэмы пры пастаяннай тэмпературы (T = const) называюць ізатэрмічным.
Калі пры пераходзе з пачатковага стану ў канчатковы маса і малярная маса ідэальнага газу не змяняюцца, то з ураўнення Клапейрона — Мендзялеева вынікае:
, або
, гэта значыць
.
(6.1)
Ціск дадзенай масы газу пры пастаянных малярнай масе і тэмпературы адваротна прапарцыянальны яго аб’ёму.
Гэтае сцвярджэнне называюць законам Бойля — Марыёта.
Праўдзівасць закона Бойля — Марыёта можна праверыць эксперыментальна, выкарыстоўваючы прыладу, паказаную на малюнку 18 у § 5.
Калі павольна змяняць аб’ём газу, які знаходзіцца ў пасудзіне, то з прычыны цеплаабмену з навакольным асяроддзем можна падтрымліваць тэмпературу газу ў пасудзіне практычна пастаяннай. Пры гэтым памяншэнне аб’ёму газу пры вярчэнні вінта 3 пацягне за сабой павелічэнне яго ціску і нязначнае павышэнне тэмпературы. І наадварот, павелічэнне аб’ёму прывядзе да памяншэння ціску і нязначнага паніжэння тэмпературы газу*.
1. Чаму бурбалкі паветра, якія знаходзяцца ў вадкасці, паднімаючыся ўверх, павялічваюцца ў аб’ёме?
2. Калі, не адрываючыся, выпіць з пластыкавай бутэлькі газаваную ваду, то можна ўбачыць, што бутэлька дэфармуецца. Чаму?
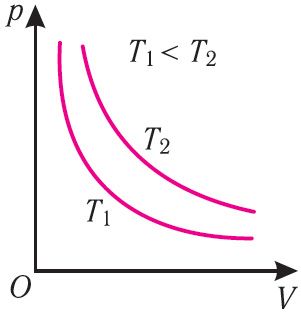
Графік ізатэрмічнага працэсу, які ажыццяўляецца ідэальным газам, у каардынатах (p, V) уяўляе з сябе гіпербалу (мал. 22). У фізіцы такую крывую называюць ізатэрмай. Розным значэнням тэмпературы газу адпавядаюць розныя ізатэрмы. Згодна з суадносінамі (6.1) для аднолькавых аб’ёмаў газаў з аднолькавымі колькасцямі рэчыва і рознымі тэмпературамі чым большы ціск, тым вышэйшая тэмпература (мал. 22).
Шматлікія доследы паказалі, што даследаваныя газы падпарадкоўваюцца закону Бойля — Марыёта тым больш дакладна, чым меншая іх шчыльнасць. Пры значным павелічэнні ціску газу гэты закон не выконваецца.
Пабудуйце графікі ізатэрмічнага працэсу ў каардынатах (p, T) і (V, T).
Цікава ведаць
Лёгкія размешчаны ў грудной клетцы, аб’ём якой пры дыханні перыядычна змяняецца дзякуючы рабоце міжрэберных мышц і дыяфрагмы. Калі грудная клетка пашыраецца, ціск паветра ў лёгкіх становіцца меншы, чым атмасферны, і паветра праз паветраносныя шляхі накіроўваецца ў лёгкія — адбываецца ўдых. Пры выдыху аб’ём грудной клеткі памяншаецца, што выклікае памяншэнне аб’ёму лёгкіх. Ціск паветра ў іх становіцца вышэйшы за атмасферны, і паветра з лёгкіх накіроўваецца ў знешняе асяроддзе.
* Нязначнае змяненне тэмпературы газу прынцыпова неабходнае для цеплаабмену з тэрмастатам — перадача цяпла магчымая толькі пры розных тэмпературах цел. ↑
Ізабарны працэс. Працэс змянення стану газу пры пастаянным ціску (p = const) называюць ізабарным.
У 1802 г. французскі вучоны Жозэф Гей-Люсак (1778–1850) разгледзеў гэты працэс для паветра, вадароду, кіслароду і азоту.
Калі пры пераходзе з пачатковага стану ў канчатковы маса і малярная маса газу не змяняюцца, то аб’ём газу, як вынікае з ураўнення Клапейрона — Мендзялеева:
, або
, гэта значыць
.
(6.2)
Аб’ём дадзенай масы газу пры пастаянных малярнай масе і ціску прама прапарцыянальны абсалютнай тэмпературы.
Гэтае сцвярджэнне называюць законам Гей-Люсака.
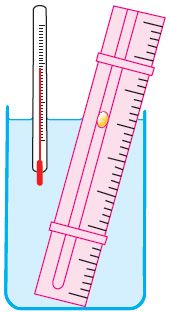
Праўдзівасць закона Гей-Люсака можна праверыць эксперыментальна, выкарыстоўваючы прыладу, паказаную на малюнку 23. Вадкасць у пасудзіне знаходзіцца ў цеплавой раўнавазе з тонкай трубкай, запоўненай паветрам, якое закрыта кропелькай алею. Пры павелічэнні тэмпературы вадкасці аб’ём паветра, што знаходзіцца ў трубцы пад кропелькай алею, узрастае і кропелька рухаецца ўверх. Пры памяншэнні тэмпературы аб’ём паветра памяншаецца — і кропелька рухаецца ўніз.
Ці можна лічыць расшырэнне газу пры павольным награванні яго ў цыліндры з рухомым поршнем ізабарным працэсам?
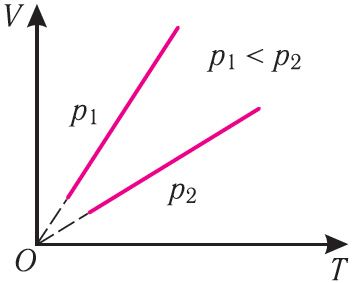
Паколькі V ~ T, то ў каардынатах (V, T) графік ізабарнага працэсу для ідэальнага газу ўяўляе з сябе прамую лінію, працяг якой праходзіць праз пачатак каардынат (мал. 24). Гэтую лінію называюць ізабарай.
Ізабара рэальных газаў не можа быць працягнутая да нулявога значэння тэмпературы (на графіку пункцірная лінія), бо пры нізкіх тэмпературах усе газы істотна адрозніваюцца ад мадэлі «ідэальны газ» і пры далейшым паніжэнні тэмпературы ператвараюцца ў вадкасці.
У адных і тых каардынатах (V, T) можна пабудаваць некалькі ізабар, якія будуць адпавядаць розным ціскам дадзенай масы ідэальнага газу пры нязменнай малярнай масе. Аналіз суадносін (6.2) дазваляе зрабіць выснову, што большаму ціску адпавядае меншы нахіл ізабары да восі тэмператур (гл. мал. 24).
Пабудуйце графікі ізабарнага працэсу ў каардынатах (p, V) і (p, T).
Ізахорны працэс. Працэс змянення стану газу пры пастаянным аб’ёме (V = const) называюць ізахорным.
Упершыню гэты працэс быў разгледжаны ў 1787 г. французскім вучоным Жакам Шарлем (1746–1823)*.
Калі пры пераходзе з пачатковага стану ў канчатковы маса і малярная маса ідэальнага газу не змяняюцца, то ціск газу, як вынікае з ураўнення Клапейрона — Мендзялеева:
, або
, гэта значыць
.
(6.3)
Ціск дадзенай масы газу пры пастаянных малярнай масе і аб’ёме прама прапарцыянальны абсалютнай тэмпературы.
Гэтае сцвярджэнне называюць законам Шарля.
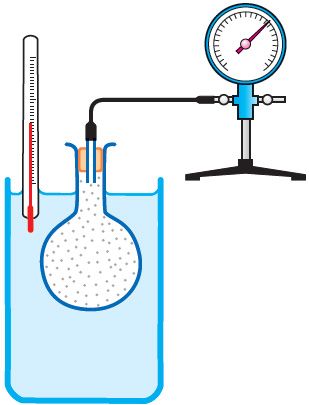
Праўдзівасць закона Шарля можна праверыць эксперыментальна, выкарыстоўваючы прыладу, паказаную на малюнку 25. Колба з паветрам, злучаная з манометрам, знаходзіцца ў цеплавой раўнавазе з вадкасцю ў пасудзіне. Пры павелічэнні тэмпературы вадкасці ціск паветра ў колбе ўзрастае, а пры памяншэнні тэмпературы ціск паветра змяншаецца.
Ідэальны газ пэўнай масы ізахорна ахалоджваюць так, што яго тэмпература памяншаецца ад t1 = 327 °С до t2 = 7 °С. У колькі разоў памяншаецца ціск газу?
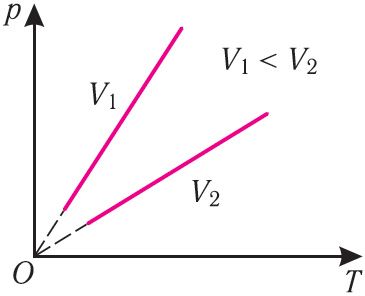
У каардынатах (p, T) графік ізахорнага працэсу, які ажыццяўляецца ідэальным газам, з’яўляецца прамой лініяй, працяг якой праходзіць праз пачатак каардынат (мал. 26). Гэтую лінію называюць ізахорай.
Як і ў выпадку ізабарнага працэсу, ізахора рэальных газаў не можа быць працягнутая да нулявога значэння тэмпературы.
У адных і тых каардынатах (p, T) можна пабудаваць некалькі ізахор, якія адпавядаюць розным аб’ёмам дадзенай масы газу пры нязменнай малярнай масе. Аналіз суадносін (6.3) паказвае, што большаму аб’ёму адпавядае меншы нахіл ізахоры да восі тэмператур (гл. мал. 26).
Пабудуйце графікі ізахорнага працэсу ў каардынатах (p, V) і (V, T).

1. Якая сувязь існуе паміж ціскам і аб’ёмам ідэальнага газу пры ізатэрмічным працэсе?
2. Якая сувязь існуе паміж аб’ёмам і абсалютнай тэмпературай ідэальнага газу пры ізабарным працэсе?
3. Якая сувязь існуе паміж ціскам і абсалютнай тэмпературай ідэальнага газу пры ізахорным працэсе?
4. Пры выкананні якіх умоў праўдзівы кожны з законаў для ізапрацэсаў у рэальным газе?
5. Аб’ём ідэальнага газу пэўнай масы і нязменнага хімічнага саставу ізабарна павялічылі ў b = 1,5 раза, а затым ціск газу ізахорна паменшылі ў с = 3 разы.
а) Як змянілася абсалютная тэмпература газу ў выніку першага працэсу?
б) Як змянілася абсалютная тэмпература газу ў выніку другога працэсу?
в) У колькі разоў пачатковая абсалютная тэмпература газу адрозніваецца ад яго канчатковай тэмпературы?
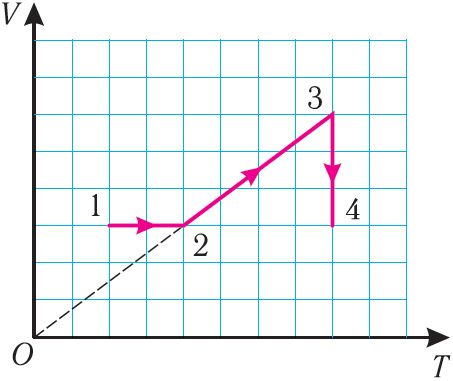
6. На малюнку 27 прыведзены графік трох працэсаў змянення стану ідэальнага газу пэўнай масы і нязменнага хімічнага саставу.
а) Якому працэсу адпавядае ўчастак 1 → 2 графіка? У колькі разоў павялічыўся ціск газу ў гэтым працэсе?
б) Якому працэсу адпавядае ўчастак 2 → 3 графіка? У колькі разоў павялічыліся аб’ём і абсалютная тэмпература газу ў гэтым працэсе?
в) Якому працэсу адпавядае ўчастак 3 → 4 графіка? Як і ў колькі разоў змяніліся аб’ём і ціск газу ў гэтым працэсе?
г) У колькі разоў трэба паменшыць тэмпературу газу, каб ізахорна перавесці газ са стану 4 у стан 2?
* Нягледзячы на тое што Шарль не апублікаваў вынікі сваіх даследаванняў, гісторыя фізікі аддае прыярытэт адкрыцця яму. ↑
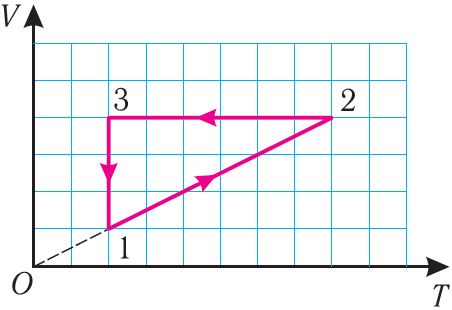
Прыклад 1. На малюнку 28 прыведзены графік трох працэсаў змянення стану пэўнай масы ідэальнага газу. Як змяняліся параметры газу на ўчастках 1 2, 2
3, 3
1? Адлюструйце гэтыя працэсы ў каардынатах (p, V) и (p, T).
Рашэнне. На ўчастку 1 2 аб’ём газу прама прапарцыянальны абсалютнай тэмпературы. Значыць, працэс пераходу газу са стану 1 у стан 2 з’яўляецца ізабарным. З графіка вынікае, што ў стане 2 тэмпература і аб’ём газу ў 4 разы большыя, чым у стане 1. Значыць, у працэсе ізабарнага расшырэння пэўнай масы газу са стану 1 у стан 2 тэмпература і аб’ём газу павялічыліся. Гэта можна запісаць такім чынам:
пераход ,
,
,
,
адбываецца ізабарнае награванне газу.
У працэсе пераходу газу са стану 2 у стан 3 застаецца пастаянным аб’ём (працэс ізахорны), а тэмпература газу памяншаецца ў 4 разы. З суадносін (6.3) вынікае, што пры ізахорным ахаладжэнні ціск газу памяншаецца прапарцыянальна яго абсалютнай тэмпературы. Таму можна запісаць:
пераход ,
,
,
адбываецца ізахорнае ахаладжэнне газу.
Працэс пераходу газу са стану 3 у стан 1 — ізатэрмічны. Пры гэтым аб’ём газу памяншаецца ў 4 разы, што цягне за сабой, згодна з законам Бойля — Марыёта, павелічэнне ціску газу ў 4 разы:
пераход ,
,
адбываецца ізатэрмічнае сцісканне газу.
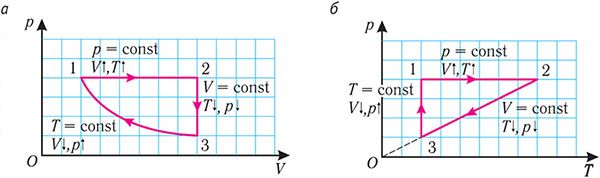
На падставе зробленых высноў адлюструем усе тры працэсы ў каардынатах (p, V) і (p, T) (мал. 29, а, б).
Прыклад 2. Пры ізатэрмічным расшырэнні ідэальнага газу пэўнай масы яго аб’ём павялічыўся ад V1 = 2,0 л да V2 = 5,0 л, а ціск зменшыўся на Δp = –15 кПа. Вызначце першапачатковы ціск газу.
V1 = 2,0 л = 2,0 · 10–3 м3
V2 = 5,0 л = 5,0 · 10–3 м3
Δp = –15 кПа = –1,5 · 104 Па
Рашэнне. Паколькі тэмпература і маса газу не змяняюцца, то яго пачатковы і канчат ковы станы звязаны з законам Бойля — Марыёта, гэта значыць . З улі кам таго, што
, атрымаем:
.
Адсюль .
.
Адказ: .
![]()
Прыклад 3. У дзвюх пасудзінах умяшчальнасцю V1 = 20 л i V2 = 30 л знаходзяцца ідэальныя газы, якія хімічна не рэагуюць. Іх ціскі p1 = 1,0 МПа і p2 = 0,40 МПа адпаведна. Вызначце ціск газаў у пасудзінах пасля таго, як іх злучылі тонкай кароткай трубкай. Тэмпература газаў перад злучэннем і пасля злучэння пасудзін аднолькавая.
V1 = 20 л = 2,0 · 10-2 м3
V2 = 30 л = 3,0 · 10-2 м3
p1 = 1,0 МПа = 1,0 · 106 Па
p2 = 0,40 МПа = 4,0 · 105 Па
T = const
Рашэнне. Ціск сумесі газаў роўны суме парцыяльных ціскаў (закон Дальтана): . Знойдзем парцыяльны ціск кожнага газу пасля злучэння пасудзін. Паколькі тэмпература і масы газаў не змяняюцца, то пачатковы і канчатковы станы кожнага газу звязаны законам Бойля — Марыёта, гэта значыць
,
.
Такім чынам, парцыяльныя ціскі газаў пасля злучэння пасудзін: ,
. Тады
.
Адказ: p = 0,64 МПа.
Практыкаванне 5
1. Пры ізабарным павелічэнні тэмпературы ідэальнага газу, які знаходзіцца ў герметычна закрытым цыліндры, на ΔT = 60,0 К яго аб’ём павялічыўся ў β = 1,21 раза. Вызначце пачатковую абсалютную тэмпературу газу.
2. Адлюструйце графічна працэс ізабарнага ахаладжэння пэўнай масы ідэальнага газу ў каардынатах (p, T); (V, T); (V, p).
3. Ідэальны газ пэўнай масы спачатку ізабарна расшырылі, а затым ізатэрмічна сціснулі да першапачатковага аб’ёму. Адлюструйце графічна гэтыя працэсы ў каардынатах (V, T); (p, V).
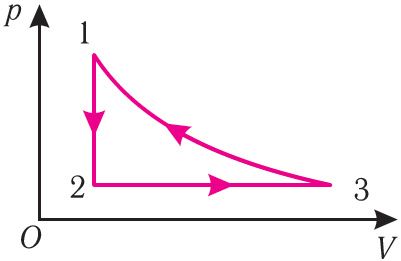
4. На малюнку 30 прыведзены графік змянення стану пэўнай масы ідэальнага газу. (Пераход 3 1 ажыццяўляецца пры нязменнай тэмпературы.) Адлюструйце гра фіч на гэты працэс у каардынатах (T, V) и (p, T).
5. Пры тэмпературы t1 = –3,0 °С манометр на балоне са сціснутым кіслародам паказваў ціск p1 = 1,8 · 106 Па, а пры тэмпературы t2 = 27 °С — ціск p2 = 2,0 · 106 Па. Вызначце, ці была ўцечка газу з балона.
![]()
6. У герметычнай пасудзіне, запоўненай паветрам (), ляжыць полы металічны шарык, дыяметр якога d = 4,0 см, а маса m = 0,64 г. Вызначце мінімальнае значэнне ціску паветра, напампаванага ў пасудзіну, пры якім бы шарык падняўся ўверх, калі тэмпература t = 17 °С застаецца пастаяннай.
7. Ідэальны газ, ціск якога p1 = 4 · 105 Па, займаў аб’ём V1 = 2 л. Спачатку газ ізатэрмічна расшырылі да аб’ёму V2 = 8 л, а затым ізахорна нагрэлі, у выніку чаго яго абсалютная тэмпература павялічылася ў α = 3 разы. Вызначце ціск р3 газу ў канцы працэсу, калі пры пераходзе з пачатковага стану ў канчатковы маса газу заставалася нязменнай.