§ 5. Уравнение состояния идеального газа
Выясним, как связаны между собой макроскопические параметры идеального газа, которые характеризуют его равновесное состояние: давление, масса всего газа, объём, предоставленный ему, и температура.
Состояние макроскопической системы полностью определено, если известны её макроскопические параметры — давление , масса
, температура
и объём
. Уравнение, связывающее параметры данного состояния, называют уравнением состояния системы. Изменение параметров состояния системы с течением времени называют процессом.
Если при переходе идеального газа из одного состояния в другое число его молекул остаётся постоянным, т. е. масса и молярная масса газа не изменяются, то из уравнений
и
следует:
,
,
(5.1)
где — постоянная Больцмана;
— параметры начального состояния газа, а
— конечного. Из соотношений (5.1) следует, что
,
или
.
(5.2)
При неизменных массе и молярной массе идеального газа отношение произведения его давления и объёма к абсолютной температуре является величиной постоянной.
Уравнение (5.2) связывает два рассматриваемых состояния идеального газа независимо от того, каким образом газ перешёл из одного состояния в другое.
Уравнение состояния в виде (5.2) впервые вывел в 1834 г. французский физик Бенуа Клапейрон (1799–1864), поэтому его называют уравнением Клапейрона.
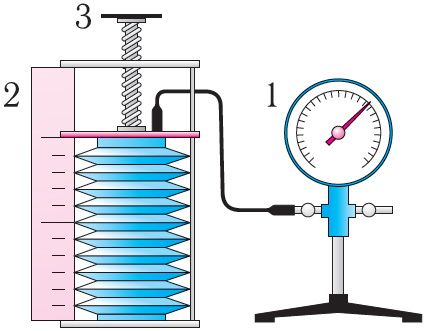
В справедливости уравнения состояния можно убедиться, воспользовавшись установкой, изображённой на рисунке 18. Манометром 1, соединённым с герметичным гофрированным сосудом, регистрируют давление газа внутри сосуда. Объём газа в сосуде можно рассчитать, используя линейку 2. Температура газа в сосуде равна температуре окружающей среды и может быть измерена термометром.
Измерив параметры газа в начальном состоянии, вычисляют отношение
. Затем помещают сосуд в горячую воду. При этом температура газа и его давление изменяются. Вращая винт 3, изменяют вместимость сосуда. Измерив снова давление газа
и температуру
, а также рассчитав предоставленный ему объём
, вычисляют отношение
Как показывают расчёты, уравнение состояния (5.2) выполняется в пределах погрешности эксперимента.
Уравнение состояния (5.2) можно применять для газов при следующих условиях:
1) не очень большие давления (пока собственный объём всех молекул газа пренебрежимо мал по сравнению с предоставленным ему объёмом);
2) не слишком низкие или же высокие температуры (пока абсолютное значение потенциальной энергии межмолекулярного взаимодействия пренебрежимо мало по сравнению с кинетической энергией теплового движения молекул).
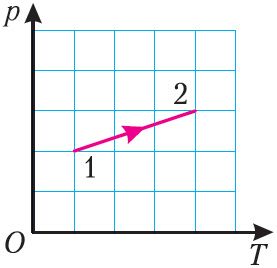
На рисунке 19 представлен график процесса перехода идеального газа данной массы из состояния 1 в состояние 2. Как изменился объём газа в результате этого процесса?
Поскольку число частиц , то из уравнения (5.1) следует:
.
(5.3)
Величину, равную произведению постоянной Больцмана и постоянной Авогадро
, назвали универсальной газовой постоянной
:
.
(5.4)
С учётом выражения (5.4) уравнение (5.3) примет вид:
.
(5.5)
Поскольку количество вещества , то формулу (5.5) можно записать в виде:
.
Уравнение состояния в виде (5.5) впервые получил русский учёный Д. И. Менделеев (1834–1907) в 1874 г., поэтому его называют уравнением Клапейрона–Менделеева.
Отметим, что уравнение Клапейрона–Менделеева связывает между собой макроскопические параметры конкретного состояния идеального газа. Используя уравнение Клапейрона–Менделеева, можно описать различные процессы, происходящие в идеальном газе.