§ 48. Алюміній і яго злучэнні
Алюміній як простае рэчыва
Фізічныя ўласцівасці. Алюміній — серабрыста-белы лёгкі метал са шчыльнасцю 2,7 г/см3, тэмпературай плаўлення +660 °С і тэмпературай кіпення +2500 °С. Ён вельмі пластычны, лёгка пракатваецца ў фольгу і працягваецца ў дрот, добра праводзіць электрычны ток.
Паверхня алюмінію заўсёды пакрыта найтанчэйшай шчыльнай плёнкай аксіду Al2O3.

Працэс атрымання аксіднай плёнкі на паверхні металаў называецца аксідзіраваннем. Плёнкі, якія ўтвараюцца, адыгрываюць ролю не толькі антыкаразійнага пакрыцця, але і матрыцы, у порах якой можна асадзіць фарбавальнае рэчыва для надання металічным вырабам дэкаратыўных уласцівасцей. На малюнку паказана стужка з аксідзіраванага алюмінію, афарбаванага ў розныя колеры.
Хімічныя ўласцівасці. У радзе актыўнасці алюміній размешчаны адразу пасля шчолачназямельных металаў, што ўказвае на яго высокую рэакцыйную здольнасць. Аднак праявіць гэтую актыўнасць пры пакаёвай тэмпературы ў многіх выпадках яму не дае шчыльная плёнка аксіду. Але пры падвышанай тэмпературы яна не перашкаджае працяканню большасці хімічных рэакцый. Абмяжуемся сістэматызацыяй вядомых вам ператварэнняў алюмінію і яго злучэнняў і прывядзём кароткія каментарыі да некаторых з іх (табл. 34).

Аксід алюмінію вылучаюць з баксіту — зямлістай глінападобнай масы, якая складаецца з гідраксіду алюмінію, аксідаў жалеза і іншых металаў, а таксама крэмнію (мал. 112.1).
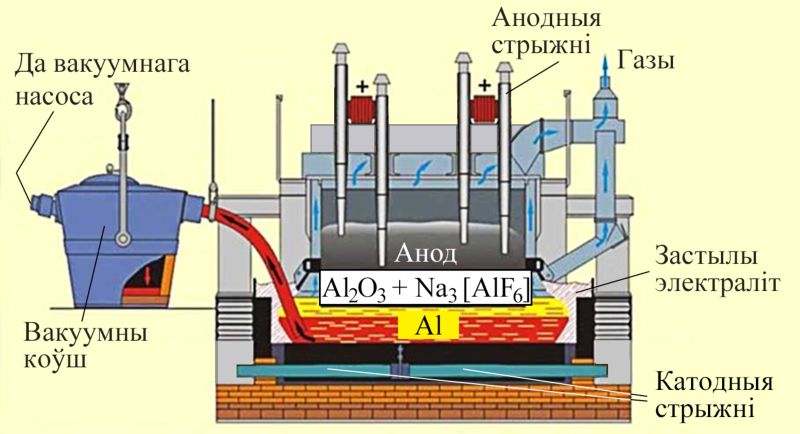
Электралізёр для атрымання алюмінію ўяўляе з сябе ванну, выкладзеную блокамі з графіту, да якой падведзены электрычны ток (мал. 112.2). У ванне пры тэмпературы 950–970 °С знаходзіцца расплаў гліназёму з крыялітам.
На катодзе — графітавым блоку на дне ванны — пры аднаўленні катыёнаў алюмінію электрычным токам вылучаецца вадкі алюміній, які перыядычна адпампоўваюць. На графітавым анодзе вылучаецца кісларод.
У струмені вылучанага кіслароду анод часткова абгарае з утварэннем СО і СО2, таму ў прамысловасці для ажыццяўлення бесперапыннага працэсу атрымання алюмінію вырашаюць праблемы рэгенеравання анодаў, падбору для іх спецыяльных матэрыялаў, абясшкоджвання вылучаных газаў.
У цяперашні час вырашаецца пытанне пра замену традыцыйнай тэхналогіі вытворчасці алюмінію на электроліз AlCl3, растворанага ў расплаве солей KCl і NaCl. Гэта дазволіць зэканоміць да 30 % энергіі, знізіць патрабаванні да сыравіны, замяніць дарагі крыяліт больш таннымі солямі, выключыць вылучэнне шкоднага фтору.
Спосаб атрымання металічнага алюмінію ў лабараторных умовах быў прапанаваны ў 1827 годзе Фрыдрыхам Вёлерам. Спосаб складаецца ў аднаўленні алюмінію з бязводнага AlCl3 каліем пры награванні без доступу паветра:
AlCl3 + 3K Al + 3KCl.
Табліца 34. Хімічныя ўласцівасці алюмінію
| Рэагенты і ўраўненні рэакцый | Умовы праходжання і прадукт рэакцыі |
| Неметалы | Al рэагуе з моцнымі акісляльнікамі пры пакаёвай тэмпературы, з менш актыўнымі — пры награванні |
| Вада | Для правядзення рэакцыі з вадой пры пакаёвай тэмпературы неабходна папярэдне выдаліць аксідную плёнку |
| Кіслоты | Al бурна рэагуе з разбаўленымі кіслотамі. У канцэнтраваных сернай і азотнай кіслотах Al пасівіруецца |
| Шчолачы | Пры ўзаемадзеянні ўтвараюцца вадарод і солі, якія ўтрымліваюць гексагідраксаалюмінат-іоны — комплексныя аніёны |
| Растворы солей | Працэсы выцяснення менш актыўнага металу алюмініем працякаюць хутчэй, калі папярэдне выдаліць плёнку Al2O3 |
| Аксіды некаторых металаў | Для ініцыявання рэакцыі сумесь рэагентаў неабходна разагрэць. Далей працэс працякае самаадвольна з вылучэннем вялікай колькасці цеплаты |
Атрыманне алюмінію. У прамысловасці алюміній атрымліваюць электролізам расплаву сумесі гліназёму Al2О3 і крыаліту Na3[AlF6]:
.
Сумесь аксіду алюмінію і крыаліту плавіцца пры тэмпературы больш чым на 1000 °С ніжэйшай, чым чысты аксід. Гэта робіць вытворчасць алюмінію больш бяспечнай, энергетычна і эканамічна больш выгаднай.
Амальгіраваны алюміній можна атрымаць, апускаючы метал на некалькі секунд у раствор солі ртуці(II).
Прымяненне алюмінію. Дзякуючы высокай электраправоднасці алюмінію з яго вырабляюць электраправады. У параўнанні з меднымі алюмініевыя правады больш лёгкія і танныя.
З-за наяўнасці на паверхні алюмінію аксіднай плёнкі ён не рэагуе з вадой, што дазваляе вырабляць з алюмінію кухонны посуд.
Шырока прымяняюцца сплавы алюмінію. З саставам і прымяненнем дзюралюмінію вы ўжо пазнаёміліся, вывучаючы матэрыял § 43, вядомы і іншыя сплавы. Авіаль — сплаў алюмінію з магніем і крэмніем — выкарыстоўваюць для вырабу карпусоў самалётаў, кузаваў аўтамабіляў, карпусоў мабільных тэлефонаў. Сплаў цынку з алюмініем і меддзю — ЦАМ — прымяняюць у аўтамабілебудаванні, для вырабу падшыпнікаў, разнастайнай фурнітуры.
Ярка выражаныя аднаўленчыя ўласцівасці алюмінію выкарыстоўваюцца ў алюматэрміі для атрымання тытану, бору, хрому і інш., для зваркі рэек і дэталей стальнога ліцця.

Для зваркі масіўных металічных дэталей, напрыклад рэек на трамвайных і чыгуначных пуцях, выкарыстоўваюць тэрміт — сумесь парашкоў Al і Fe3О4. Пры іх узаемадзеянні вылучаецца велізарная колькасць цеплаты:
.
Тэмпература павышаецца да 2800 °С. Гэта выклікае плаўленне адноўленага жалеза, якое, сцякаючы ў стык рэек, запаўняе прастору паміж імі і зварвае іх.