§ 48. Алюміній і яго злучэнні
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 48. Алюміній і яго злучэнні |
| Напечатано:: | Гость |
| Дата: | Суббота, 26 Июль 2025, 14:01 |
Алюміній як хімічны элемент

Алюміній — элемент 3-га перыяду, IIIA-групы. Электронная схема, формула электроннай канфігурацыі і электронна-графічная схема яго атама маюць выгляд:
13Al ![]() або 13Аl 2е–, 8е–, 3е–;
або 13Аl 2е–, 8е–, 3е–;
13Аl 1s22s22p63s23p1 або 13Аl [Ne]3s23p1;
13Al 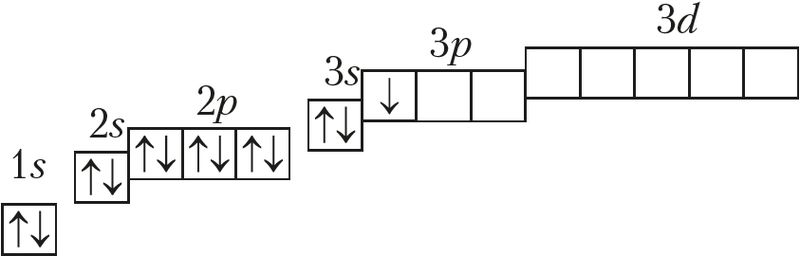
На знешнім электронным слоі ў атамаў алюмінію знаходзіцца тры электроны, канфігурацыя валентнасці слоя 3s23p1, гэта значыць алюміній адносіцца да р-элементаў. Ён мае нізкае значэнне электраадмоўнасці χ(Al) = 1,6 і праяўляе ў злучэннях ступень акіслення толькі +3.
Алюміній — самы распаўсюджаны метал у зямной кары (ω(Al) = 7,5 %, (§ 43, мал. 102). У прыродзе ён прадстаўлены адзіным нуклідам .
З прычыны значнай хімічнай актыўнасці алюміній у прыродных умовах знаходзіцца пераважна ў выглядзе хімічных злучэнняў — мінералаў, якія ўяўляюць сабой аксіды, гідраксіды, сілікаты або алюмасілікаты. Напрыклад, прадукт разбурэння горных парод — гліна (каалін), прадукты далейшага разбурэння гліны — баксіты Al2O3 · xH2O. Найбольшае практычнае значэнне для атрымання алюмінію маюць баксіты і крыаліт Na3[AlF6].
Алюміній як простае рэчыва
Фізічныя ўласцівасці. Алюміній — серабрыста-белы лёгкі метал са шчыльнасцю 2,7 г/см3, тэмпературай плаўлення +660 °С і тэмпературай кіпення +2500 °С. Ён вельмі пластычны, лёгка пракатваецца ў фольгу і працягваецца ў дрот, добра праводзіць электрычны ток.
Паверхня алюмінію заўсёды пакрыта найтанчэйшай шчыльнай плёнкай аксіду Al2O3.

Працэс атрымання аксіднай плёнкі на паверхні металаў называецца аксідзіраваннем. Плёнкі, якія ўтвараюцца, адыгрываюць ролю не толькі антыкаразійнага пакрыцця, але і матрыцы, у порах якой можна асадзіць фарбавальнае рэчыва для надання металічным вырабам дэкаратыўных уласцівасцей. На малюнку паказана стужка з аксідзіраванага алюмінію, афарбаванага ў розныя колеры.
Хімічныя ўласцівасці. У радзе актыўнасці алюміній размешчаны адразу пасля шчолачназямельных металаў, што ўказвае на яго высокую рэакцыйную здольнасць. Аднак праявіць гэтую актыўнасць пры пакаёвай тэмпературы ў многіх выпадках яму не дае шчыльная плёнка аксіду. Але пры падвышанай тэмпературы яна не перашкаджае працяканню большасці хімічных рэакцый. Абмяжуемся сістэматызацыяй вядомых вам ператварэнняў алюмінію і яго злучэнняў і прывядзём кароткія каментарыі да некаторых з іх (табл. 34).

Аксід алюмінію вылучаюць з баксіту — зямлістай глінападобнай масы, якая складаецца з гідраксіду алюмінію, аксідаў жалеза і іншых металаў, а таксама крэмнію (мал. 112.1).
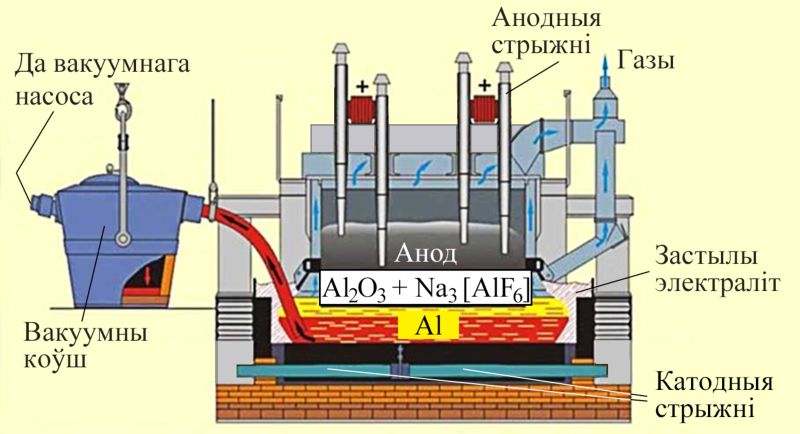
Электралізёр для атрымання алюмінію ўяўляе з сябе ванну, выкладзеную блокамі з графіту, да якой падведзены электрычны ток (мал. 112.2). У ванне пры тэмпературы 950–970 °С знаходзіцца расплаў гліназёму з крыялітам.
На катодзе — графітавым блоку на дне ванны — пры аднаўленні катыёнаў алюмінію электрычным токам вылучаецца вадкі алюміній, які перыядычна адпампоўваюць. На графітавым анодзе вылучаецца кісларод.
У струмені вылучанага кіслароду анод часткова абгарае з утварэннем СО і СО2, таму ў прамысловасці для ажыццяўлення бесперапыннага працэсу атрымання алюмінію вырашаюць праблемы рэгенеравання анодаў, падбору для іх спецыяльных матэрыялаў, абясшкоджвання вылучаных газаў.
У цяперашні час вырашаецца пытанне пра замену традыцыйнай тэхналогіі вытворчасці алюмінію на электроліз AlCl3, растворанага ў расплаве солей KCl і NaCl. Гэта дазволіць зэканоміць да 30 % энергіі, знізіць патрабаванні да сыравіны, замяніць дарагі крыяліт больш таннымі солямі, выключыць вылучэнне шкоднага фтору.
Спосаб атрымання металічнага алюмінію ў лабараторных умовах быў прапанаваны ў 1827 годзе Фрыдрыхам Вёлерам. Спосаб складаецца ў аднаўленні алюмінію з бязводнага AlCl3 каліем пры награванні без доступу паветра:
AlCl3 + 3K Al + 3KCl.
Табліца 34. Хімічныя ўласцівасці алюмінію
| Рэагенты і ўраўненні рэакцый | Умовы праходжання і прадукт рэакцыі |
| Неметалы | Al рэагуе з моцнымі акісляльнікамі пры пакаёвай тэмпературы, з менш актыўнымі — пры награванні |
| Вада | Для правядзення рэакцыі з вадой пры пакаёвай тэмпературы неабходна папярэдне выдаліць аксідную плёнку |
| Кіслоты | Al бурна рэагуе з разбаўленымі кіслотамі. У канцэнтраваных сернай і азотнай кіслотах Al пасівіруецца |
| Шчолачы | Пры ўзаемадзеянні ўтвараюцца вадарод і солі, якія ўтрымліваюць гексагідраксаалюмінат-іоны — комплексныя аніёны |
| Растворы солей | Працэсы выцяснення менш актыўнага металу алюмініем працякаюць хутчэй, калі папярэдне выдаліць плёнку Al2O3 |
| Аксіды некаторых металаў | Для ініцыявання рэакцыі сумесь рэагентаў неабходна разагрэць. Далей працэс працякае самаадвольна з вылучэннем вялікай колькасці цеплаты |
Атрыманне алюмінію. У прамысловасці алюміній атрымліваюць электролізам расплаву сумесі гліназёму Al2О3 і крыаліту Na3[AlF6]:
.
Сумесь аксіду алюмінію і крыаліту плавіцца пры тэмпературы больш чым на 1000 °С ніжэйшай, чым чысты аксід. Гэта робіць вытворчасць алюмінію больш бяспечнай, энергетычна і эканамічна больш выгаднай.
Амальгіраваны алюміній можна атрымаць, апускаючы метал на некалькі секунд у раствор солі ртуці(II).
Прымяненне алюмінію. Дзякуючы высокай электраправоднасці алюмінію з яго вырабляюць электраправады. У параўнанні з меднымі алюмініевыя правады больш лёгкія і танныя.
З-за наяўнасці на паверхні алюмінію аксіднай плёнкі ён не рэагуе з вадой, што дазваляе вырабляць з алюмінію кухонны посуд.
Шырока прымяняюцца сплавы алюмінію. З саставам і прымяненнем дзюралюмінію вы ўжо пазнаёміліся, вывучаючы матэрыял § 43, вядомы і іншыя сплавы. Авіаль — сплаў алюмінію з магніем і крэмніем — выкарыстоўваюць для вырабу карпусоў самалётаў, кузаваў аўтамабіляў, карпусоў мабільных тэлефонаў. Сплаў цынку з алюмініем і меддзю — ЦАМ — прымяняюць у аўтамабілебудаванні, для вырабу падшыпнікаў, разнастайнай фурнітуры.
Ярка выражаныя аднаўленчыя ўласцівасці алюмінію выкарыстоўваюцца ў алюматэрміі для атрымання тытану, бору, хрому і інш., для зваркі рэек і дэталей стальнога ліцця.

Для зваркі масіўных металічных дэталей, напрыклад рэек на трамвайных і чыгуначных пуцях, выкарыстоўваюць тэрміт — сумесь парашкоў Al і Fe3О4. Пры іх узаемадзеянні вылучаецца велізарная колькасць цеплаты:
.
Тэмпература павышаецца да 2800 °С. Гэта выклікае плаўленне адноўленага жалеза, якое, сцякаючы ў стык рэек, запаўняе прастору паміж імі і зварвае іх.
Злучэнні алюмінію
Аксід алюмінію Al2O3 — тыповы амфатэрны аксід, які рэагуе як з кіслотамі, так і са шчолачамі:
Утвораны ў прыродных умовах аксід алюмінію існуе ў выглядзе карунду. Па цвёрдасці ён саступае толькі алмазу (Дадатак 2). Празрыстыя афарбаваныя крышталі карунду адносяць да каштоўных камянёў — самацветаў: сапфір (Al2O3 з прымесямі тытану, ванадыю, жалеза) афарбаваны ў сіні колер, рубін (Al2O3 з прымесямі хрому і жалеза) — у чырвоны. Штучна вырашчаныя монакрышталі рубіну выкарыстоўваюць у лазерах, гадзіннікавай і ювелірнай прамысловасці.
Парашок карунду Al2O3 дзякуючы яго цвёрдасці ўжываюць пры шліфоўцы і паліраванні розных паверхняў. Цвёрды, тугаплаўкі і хімічна інертны аксід алюмінію з’яўляецца асноўным кампанентам вогнетрывалых матэрыялаў — цэглы, керамікі, фарфору.
Гідраксід алюмінію Al(ОН)3 — белы рыхлы парашок, які рэагуе і з кіслотамі, і са шчолачамі (як у растворы, так і пры сплаўленні):
Такім чынам, гідраксід алюмінію валодае амфатэрнымі ўласцівасцямі.
Пры награванні гідраксід алюмінію раскладаецца на аксід і ваду:
.
Ён можа быць атрыманы ў выглядзе студзяністападобнага асадку пры дзеянні воднага раствору аміяку на растворы солей алюмінію:
.
У лішку аміяку асадак не раствараецца. Пры выкарыстанні для яго асаджэння раствораў NaОН і KОН лішак шчолачаў можа прывесці да растварэння ўтворанага асадку Аl(ОН)3. Таму, атрымліваючы гідраксід алюмінію ў лабараторыі, да раствору солі асцярожна дадаюць раствор шчолачы (але не наадварот!).
Растваральныя солі алюмінію часткова рэагуюць з вадой з утварэннем асноўнай солі і кіслаты:
.
Па прычыне ўзаемадзеяння солей алюмінію з вадой па абменнай рэакцыі ў растворы нельга атрымаць нерастваральную соль алюмінію і слабай кіслаты (напрыклад, фтарыд, сульфід, карбанат алюмінію).
Прымяненне і біялагічная роля злучэнняў алюмінію. Гідраксід алюмінію ўжываюць у якасці асновы для абвалакальных і абязбольвальных сродкаў пры лячэнні апёкаў і страўнікава-кішэчных захворванняў. Алюмакаліевыя квасцы — крышталегідрат саставу K2SO4 · Al2(SО4)3 · 24Н2О — выкарыстоўваюць ў медыцынскай практыцы як кровааднаўляльны сродак, у касметалогіі — у саставе дэзадарантаў, у тэкстыльнай прамысловасці — для апрацоўкі тканін перад фарбаваннем, у гарбарнай — пры дубленні скуры.
Залішняе паступленне алюмінію ў арганізм чалавека можа прывесці да крохкасці касцей і парушэння памяці.
Алюміній — прадстаўнік р-элементаў, актыўны метал, аднаўляе вадарод з вады, металы з іх аксідаў.
Алюміній, яго аксід Al2О3 і гідраксід Al(ОН)3 рэагуюць як з кіслотамі, так і са шчолачамі, гэта значыць валодаюць амфатэрнымі ўласцівасцямі.
Пытанні, заданні, задачы
1. Чаму алюміній называюць:
- а) «крылатым металам»;
- б) «серабром з гліны»?
2. Параўнайце электронную будову атама алюмінію і яго трохзараднага катыёна.
3. Складзіце характарыстыку алюмінію як хімічнага элемента згодна з планам, прыведзеным у § 12.
4. Складзіце электронны баланс рэакцыі ўзаемадзеяння алюмініяю з разбаўленай азотнай кіслатой, ураўненне якой даецца ў тэксце параграфа. Ахарактарызуйце гэтую рэакцыю згодна з планам, прыведзеным у § 18.
5. Разлічыце аб’ём вадароду, які вылучыўся пры ўзаемадзеянні алюмінію масай 13,5 г з канцэнтраваным растворам гідраксіду натрыю.
6. Метадам электроннага балансу расстаўце каэфіцыенты ў схемах рэакцый алюмінію з канцэнтраванымі азотнай і сернай кіслотамі пры награванні:
7. Да раствору нітрату алюмінію дадалі невялікую колькасць раствору гідраксіду калію. Атрыманы асадак падзялілі на дзве часткі і растварылі ў сернай кіслаце і шчолачы (KОН) адпаведна. Складзіце ўраўненні рэакцый, якія адбыліся, у малекулярнай і іоннай формах.
8. Алюмакаліевыя квасцы K2SO4 · Al2(SО4)3 · 24Н2О масай 4,74 г растварылі ў вадзе (у мернай колбе) і аб’ём давялі да 200 см3. Разлічыце малярную канцэнтрацыю іонаў алюмінію ў растворы.
9. Алюмініевую пласцінку апусцілі ў раствор, які змяшчае нітрат ртуці(II) колькасцю 0,02 моль, і дасталі пасля поўнага здабывання ртуці з раствору. Вызначце:
- а) масу ртуці, якая асела на паверхні пласцінкі;
- б) масу прарэагаваўшага алюмінію;
- в) канчатковую масу пласцінкі, калі зыходная была роўная 15,51 г.
10. Прывядзіце ўраўненні хімічных рэакцый, з дапамогай якіх можна ажыццявіць наступныя ператварэнні:
- а)
;
- б)
.
Ураўненні рэакцый, якія праходзяць у растворах, выразіце ў малекулярнай і іоннай формах, пакажыце ступені акіслення атамаў у акісляльна-аднаўленчых рэакцыях.
*Самакантроль
1. Атам алюмінію ў асноўным стане змяшчае:
- а) адзін р-электрон;
- б) сем р-электронаў;
- в) два s-электроны;
- г) шэсць s-электронаў.
2. Алюмінатэрмія — гэта:
- а) спосаб атрымання металаў;
- б) высокатэмпературны працэс;
- в) спосаб атрымання люстэркаў з алюмініевым пакрыццём;
- г) прамысловае атрыманне алюмінію.
3. Прадуктам ператварэння Al(OH)3 + NaOH → з’яўляецца:
- а) NaAlO2;
- б) H2O;
- в) Na3[Al(OH)6];
- г) H2.
4. Аксід алюмінію ўступае ў рэакцыі з:
- а) HCl;
- б) H2O;
- в) KOH;
- г) H2.
5. Пры пакаёвай тэмпературы алюміній не рэагуе з:
- а) HNO3(разб);
- б) H2SO4(канц);
- в) HNO3(канц);
- г) HCl(канц).