§ 39. Кіслародзмяшчальныя злучэнні фосфару
Фосфарная кіслата
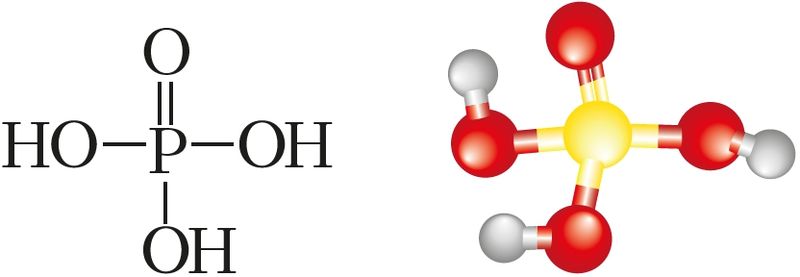
Хімічныя і фізічныя ўласцівасці. Фосфар утварае некалькі кіслот, аднак самая ўстойлівая фосфарная кіслата H3PO4 (мал. 96). Са структурнай формулы яе малекулы відаць, што кіслата трохасноўная. H3PO4 — рэчыва, тэмпература плаўлення якога 42,35 °С. Гэта азначае, што пры пакаёвай тэмпературы фосфарная кіслата — цвёрдае рэчыва. Фосфарная кіслата добра растваральная ў вадзе. У водным растворы дысацыіруе ступеньчата:
Фосфарная кіслата — слабы электраліт, дысацыіруе пераважна па першай ступені. У растворах яна праяўляе агульныя ўласцівасці кіслот: змяняе колер індыкатараў і ўтварае солі ў рэакцыях з металамі, якія знаходзяцца ў радзе актыўнасці да вадароду (1), асноўнымі і амфатэрнымі аксідамі (2), гідраксідамі металаў і аміякам (3), іншымі солямі (4); яна не з’яўляецца акісляльнікам за кошт аніёна:
Адзначым, што фосфарная кіслата ўтварае як сярэднія солі (фасфаты), так і кіслыя (гідрафасфаты і дыгідрафасфаты), у залежнасці ад суадносін зыходных рэчываў. Напрыклад:
3КOH + H3PO4 = К3PO4 + 3H2O (фасфат калію) (3 : 1);
2КOH + H3PO4 = К2HPO4 + 2H2O (гідрафасфат калію) (2 : 1);
КOH + H3PO4 = КН2PO4 + H2O (дыгідрафасфат калію) (1 : 1).
Пры складанні ўраўненняў рэакцый у іоннай форме фосфарную кіслату прадстаўляюць у выглядзе малекул як пераважных часціц у яе растворы. Напрыклад:
Прымяненне і атрыманне. Фосфарную кіслату выкарыстоўваюць у вытворчасці ўгнаенняў і кармавых сродкаў, для фарміравання антыкаразійных пакрыццяў на металах, а таксама ў харчовай прамысловасці для надання кіславатага смаку безалкагольным напоям, для асвятлення цукру.
Атрымліваюць H3PO4 узаемадзеяннем прыродных фасфатаў з сернай кіслатой пры 60–80 °С з наступным адфільтраваннем асадку СаSO4. Пры гэтым фосфарная кіслата ўтвараецца ў выглядзе сіропападобнага раствору з масавай доляй рэчыва 85 %. Другі спосаб — спальванне фосфару, атрыманага напальваннем прыроднага фасфату з пяском і вугалем, і наступнае растварэнне аксіду ў вадзе:
Сa3(PO4)2 → Р → P2O5 → H3PO4.
Солі фосфарнай кіслаты. Фасфаты, як правіла, нерастваральныя, за выключэннем солей натрыю, калію і амонію. Кіслыя солі больш растваральныя, чым сярэднія, а дыгідрафасфаты маюць большую растваральнасць, чым гідрафасфаты. Напрыклад, фасфат Ca3(PO4)2 нерастваральны, гідрафасфат CaHPO4 — маларастваральны, а дыгідрафасфат Ca(H2PO4)2 добра раствараецца ў вадзе. Большасць фасфатаў валодае высокай тэрмічнай устойлівасцю — не разбураецца пры награванні да тэмпературы плаўлення. Характэрная асаблівасць фасфатаў (сярэдніх солей) — утварэнне асадку жоўтага колеру пры дзеянні раствору нітрату серабра(I) (Дадатак 3):
У адрозненне ад светла-жоўтага асадку браміду серабра(I) і жоўтага асадку ёдыду серабра(I), фасфат серабра(I) раствараецца пры дадаванні азотнай кіслаты.
Прымяненне солей фосфарнай кіслаты. Многія сярэднія і кіслыя солі фосфарнай кіслаты (Ca3(PO4)2, CaHPO4 ∙ 2H2O, Ca(H2PO4)2 ∙ H2O, NН4H2PO4, (NН4)2HPO4) выкарыстоўваюцца ў якасці ўгнаенняў. Фасфаты знаходзяць прымяненне ў вытворчасці каўчуку, пластмас, у металургіі. Фасфат натрыю памяншае жорсткасць вады і паляпшае мыйнае дзеянне пральных парашкоў. Тым не менш у многіх дзяржавах у цяперашні час уведзены абмежаванні выкарыстання фасфатаў у якасці пральных сродкаў. Справа ў тым, што пасля мыцця фасфаты трапляюць у сцёкавыя вады, а потым у вадаёмы, спрыяючы бурнаму развіццю планктону і водарасцяў — вадаёмы «старэюць». Паводле некаторых звестак, 1 г фасфату стымулюе рост 5–10 кг водарасцяў.