§ 39. Кіслародзмяшчальныя злучэнні фосфару
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 39. Кіслародзмяшчальныя злучэнні фосфару |
| Напечатано:: | Гость |
| Дата: | Пятница, 15 Август 2025, 04:47 |
Да найбольш значных кіслародзмяшчальных злучэнняў фосфару адносяць аксід фосфару(V), фосфарную кіслату і яе солі.
Аксіды фосфару
Узаемадзеянне кіслароду з фосфарам прыводзіць да ўтварэння аксідаў, састаў якіх залежыць ад умоў правядзення рэакцыі.
Пры спальванні фосфару ў чыстым кіслародзе, як паказана на с. 201, атрымліваецца аксід фосфару(V) P2O5, а пры недахопе кіслароду — аксід фосфару(III) P2O3.
Белы фосфар — адно з першых дыматворных рэчываў, пры спальванні якога падчас ваенных дзеянняў утваралася дымавая заслона з часціц P2O5. Дым — дысперсная сістэма, што складаецца з цвёрдых узважаных часціц у газавым асяроддзі.
Аксід фосфару(V) лічаць самым эфектыўным асушальнікам. Прычым асушальнікам з’яўляецца і ўтвораная пры гэтым кіслата. Абыходзіцца з P2O5 варта вельмі асцярожна, бо пры кантакце са скурай аксід выклікае моцныя апёкі, адна з прычын — абязводжванне тканак.
Аксід фосфару(V) — найвышэйшы аксід фосфару, і яму адпавядае гідраксід
— фосфарная (або артафосфарная) кіслата.
P2O5 — белае цвёрдае рэчыва (Tпл.= 420 °С). З’яўляецца тыповым кіслотным аксідам: рэагуе з вадой (1), асноўнымі аксідамі (2) і шчолачамі (3), шырока выкарыстоўваецца ў арганічным сінтэзе. Разгледзім асаблівасці гэтых рэакцый:
1. Канчатковым прадуктам рэакцыі аксіду фосфару(V) з вадой з’яўляецца фосфарная кіслата H3PO4:
3H2O + P2O5 = 2H3PO4.
Аксід фосфару(V) не толькі раствараецца ў вадзе, але і «прагна» паглынае пары вады з паветра, гэта значыць ён гіграскапічны, выкарыстоўваецца ў якасці асушальніку.
2. Узаемадзеянне з асноўнымі і амфатэрнымі аксідамі прыводзіць да ўтварэння солей:
3СаО + P2O5 = Са3(РО4)2;
3ZnО + P2O5 = Zn3(РО4)2.
3. Пры растварэнні P2O5 у шчолачах могуць утварацца як сярэднія, так і кіслыя солі (у залежнасці ад суадносін рэагентаў). Напрыклад, пры ўзаемадзеянні з гідраксідам натрыю могуць утварацца Na3PO4, Na2HPO4 або NaH2PO4:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O;
P2O5 + 4NaOH = 2Na2HPO4 + H2O;
P2O5 + 2NaOH + H2O = 2NaH2PO4.
Фосфарная кіслата
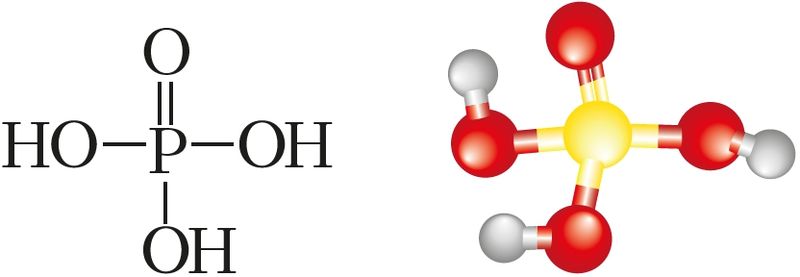
Хімічныя і фізічныя ўласцівасці. Фосфар утварае некалькі кіслот, аднак самая ўстойлівая фосфарная кіслата H3PO4 (мал. 96). Са структурнай формулы яе малекулы відаць, што кіслата трохасноўная. H3PO4 — рэчыва, тэмпература плаўлення якога 42,35 °С. Гэта азначае, што пры пакаёвай тэмпературы фосфарная кіслата — цвёрдае рэчыва. Фосфарная кіслата добра растваральная ў вадзе. У водным растворы дысацыіруе ступеньчата:
Фосфарная кіслата — слабы электраліт, дысацыіруе пераважна па першай ступені. У растворах яна праяўляе агульныя ўласцівасці кіслот: змяняе колер індыкатараў і ўтварае солі ў рэакцыях з металамі, якія знаходзяцца ў радзе актыўнасці да вадароду (1), асноўнымі і амфатэрнымі аксідамі (2), гідраксідамі металаў і аміякам (3), іншымі солямі (4); яна не з’яўляецца акісляльнікам за кошт аніёна:
Адзначым, што фосфарная кіслата ўтварае як сярэднія солі (фасфаты), так і кіслыя (гідрафасфаты і дыгідрафасфаты), у залежнасці ад суадносін зыходных рэчываў. Напрыклад:
3КOH + H3PO4 = К3PO4 + 3H2O (фасфат калію) (3 : 1);
2КOH + H3PO4 = К2HPO4 + 2H2O (гідрафасфат калію) (2 : 1);
КOH + H3PO4 = КН2PO4 + H2O (дыгідрафасфат калію) (1 : 1).
Пры складанні ўраўненняў рэакцый у іоннай форме фосфарную кіслату прадстаўляюць у выглядзе малекул як пераважных часціц у яе растворы. Напрыклад:
Прымяненне і атрыманне. Фосфарную кіслату выкарыстоўваюць у вытворчасці ўгнаенняў і кармавых сродкаў, для фарміравання антыкаразійных пакрыццяў на металах, а таксама ў харчовай прамысловасці для надання кіславатага смаку безалкагольным напоям, для асвятлення цукру.
Атрымліваюць H3PO4 узаемадзеяннем прыродных фасфатаў з сернай кіслатой пры 60–80 °С з наступным адфільтраваннем асадку СаSO4. Пры гэтым фосфарная кіслата ўтвараецца ў выглядзе сіропападобнага раствору з масавай доляй рэчыва 85 %. Другі спосаб — спальванне фосфару, атрыманага напальваннем прыроднага фасфату з пяском і вугалем, і наступнае растварэнне аксіду ў вадзе:
Сa3(PO4)2 → Р → P2O5 → H3PO4.
Солі фосфарнай кіслаты. Фасфаты, як правіла, нерастваральныя, за выключэннем солей натрыю, калію і амонію. Кіслыя солі больш растваральныя, чым сярэднія, а дыгідрафасфаты маюць большую растваральнасць, чым гідрафасфаты. Напрыклад, фасфат Ca3(PO4)2 нерастваральны, гідрафасфат CaHPO4 — маларастваральны, а дыгідрафасфат Ca(H2PO4)2 добра раствараецца ў вадзе. Большасць фасфатаў валодае высокай тэрмічнай устойлівасцю — не разбураецца пры награванні да тэмпературы плаўлення. Характэрная асаблівасць фасфатаў (сярэдніх солей) — утварэнне асадку жоўтага колеру пры дзеянні раствору нітрату серабра(I) (Дадатак 3):
У адрозненне ад светла-жоўтага асадку браміду серабра(I) і жоўтага асадку ёдыду серабра(I), фасфат серабра(I) раствараецца пры дадаванні азотнай кіслаты.
Прымяненне солей фосфарнай кіслаты. Многія сярэднія і кіслыя солі фосфарнай кіслаты (Ca3(PO4)2, CaHPO4 ∙ 2H2O, Ca(H2PO4)2 ∙ H2O, NН4H2PO4, (NН4)2HPO4) выкарыстоўваюцца ў якасці ўгнаенняў. Фасфаты знаходзяць прымяненне ў вытворчасці каўчуку, пластмас, у металургіі. Фасфат натрыю памяншае жорсткасць вады і паляпшае мыйнае дзеянне пральных парашкоў. Тым не менш у многіх дзяржавах у цяперашні час уведзены абмежаванні выкарыстання фасфатаў у якасці пральных сродкаў. Справа ў тым, што пасля мыцця фасфаты трапляюць у сцёкавыя вады, а потым у вадаёмы, спрыяючы бурнаму развіццю планктону і водарасцяў — вадаёмы «старэюць». Паводле некаторых звестак, 1 г фасфату стымулюе рост 5–10 кг водарасцяў.
Аксід фосфару(V) — кіслотны аксід.
Фосфарная кіслата, у адрозненне ад азотнай, з’яўляецца пры н. у. цвёрдым рэчывам, адносіцца да слабых кіслот і акісляльныя ўласцівасці выяўляе толькі за кошт атамаў вадароду.
Солі фосфарнай кіслаты — фасфаты, гідрафасфаты і дыгідрафасфаты — знаходзяць шырокае ўжыванне ў якасці ўгнаенняў.
Пытанні, заданні, задачы
1. Назавіце класы рэчываў, з якімі ўзаемадзейнічае:
- а) аксід фосфару(V);
- б) фосфарная кіслата.
2. Складзіце формулы:
- а) дыгідрафасфату калію; дыгідрафасфату кальцыю; гідрафасфату магнію; фасфату жалеза(III);
- б) дыгідрафасфату магнію; гідрафасфату жалеза(III); гідра фасфату цынку; фасфату натрыю.
Запішыце ўраўненні іх электралітычнай дысацыяцыі, улічваючы адшчапленне толькі іонаў металу.
3. Запішыце тры ўраўненні паслядоўных рэакцый, якія адбываюцца пры дадаванні раствору:
- а) гідраксіду калію да раствору фосфарнай кіслаты;
- б) фосфарнай кіслаты да раствору гідраксіду натрыю.
Назавіце ўтвораныя солі.
4. Складзіце ўраўненні рэакцый з улікам названых каэфіцыентаў:
- а)
;
- б)
.
5. Вызначце колькасць цеплаты, якая вылучаецца пры згаранні фосфару масай 1 кг паводле тэрмахімічнага ўраўнення рэакцыі:
4Р(г) + 5О2(г) = 2Р2О5(цв) + 3010 кДж.
6. Ці можна ў якасці асушальніку газападобнага аміяку ўжываць P2O5? Адказ аргументуйце.
7. У трох пранумараваных прабірках знаходзяцца растворы нітрату калію, фасфату калію, хларыду натрыю. Прапануйце план распазнання рэчываў. Патлумачце ўраўненнямі рэакцый у малекулярнай і іоннай формах.
8. Складзіце ўраўненні рэакцый паводле схемы:
- а)
;
- б)
.
9. Неабходна прыгатаваць раствор фосфарнай кіслаты масай 500 г з масавай доляй рэчыва 5 %. Разлічыце масы неабходных для гэтай мэты аксіду фосфару(V) і вады.
10. Разлічыце аб’ём паветра (н. у.), неабходны для спальвання фосфару масай 1 кг. Чаму роўная маса фосфарнай кіслаты, якая ўтвараецца пры растварэнні атрыманага аксіду фосфару(V)?
*Самакантроль
1. Аксід фосфару P2O5 з’яўляецца:
- а) солеўтваральным;
- б) адноўнікам;
- в) вадкім пры н. у.;
- г) кіслотным.
2. Для фосфарнай кіслаты справядлівыя сцвярджэнні:
- а) моцная двухасноўная кіслата;
- б) у водных растворах — слабы электраліт;
- в) утварае тры віды солей — фасфаты, гідра- і дыгідрафасфаты;
- г) H3PO4 адпавядае аксіду фосфару(III).
3. Асадак жоўтага колеру з нітратам серабра(I) утвараюць растворы:
- a) Nа3РO4;
- б) K3PO4;
- в) KI;
- г) NaNO3.
4. Правільна складзеныя формулы солей фосфарнай кіслаты:
- а) Nа2РO4;
- б) (NH4)2НРO4;
- в) Zn2(РO4)3;
- г) Al(Н2РO4)3.
5. Пры мольных суадносінах аміяку і аксіду фосфару(V) 2 : 1 у водным растворы ўтвараецца:
- а) фасфат амонію;
- б) нітрат фосфару;
- в) гідрафасфат амонію;
- г) дыгідрафасфат амонію.