§ 34. Кіслародныя злучэнні серы
Аксід серы(IV)
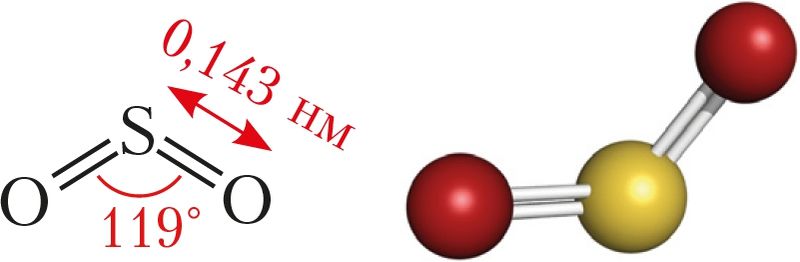
Аксід серы(IV) — рэчыва малекулярнай будовы (мал. 79).
Фізічныя ўласцівасці. Аксід серы(IV) пры нармальных умовах уяўляе сабой бясколерны газ з характэрным рэзкім пахам — пахам запалкі, якая загараецца. Газ таксічны. У адным аб’ёме вады раствараецца каля 40 аб’ёмаў газу пры 20 °С, што значна ніжэй, чым у выпадку хлоравадароду і аміяку. Тэмпература яго кіпення нашмат вышэйшая, чым у кіслароду, і роўная –10 °С. Газ лёгка звадкоўваецца пры пакаёвай тэмпературы ўжо пры невялікім ціску, што дазваляе захоўваць і транспартаваць звадкаваны газ у балонах (мал. 80).

Хімічныя ўласцівасці. У хімічных рэакцыях, якія праходзяць без змены ступені акіслення, аксід серы(IV) павінен праяўляць уласцівасці кіслотнага аксіду: з вадой ён павінен утвараць кіслату, са шчолачамі і асноўнымі аксідамі — солі. Паколькі найніжэйшая ступень акіслення серы роўная –2, а найвышэйшая +6, варта выказаць меркаванне, што для сярністага газу характэрны рэакцыі як з павышэннем ступені акіслення серы, так і з яе паніжэннем.
Пры павышэнні ступені акіслення атамы серы «губляюць» электроны. Гэта азначае, што аксід праяўляе ўласцівасці адноўніку — рэагуе з акісляльнікамі, напрыклад з кіслародам, хлорам. Паніжаючы ступень акіслення, атамы серы далучаюць электроны, а сярністы газ выступае ў ролі акісляльніку. Гэта адбываецца пры ўзаемадзеянні з моцнымі адноўнікам, напрыклад СО, РН3.
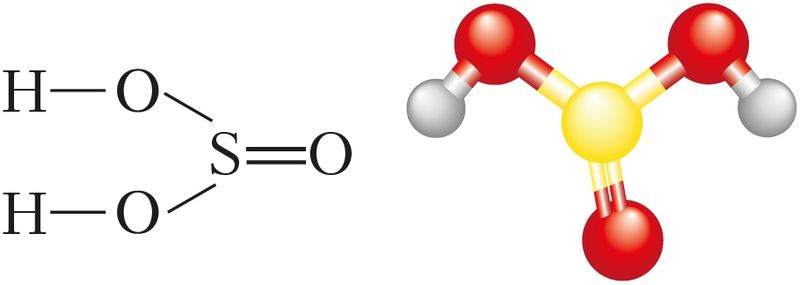
Пракаментуем сказанае і растлумачым ураўненнямі хімічных рэакцый.
I. Рэакцыі без змены ступені акіслення.
1. Рэакцыя з вадой. Пры прапусканні сярністага газу праз ваду, у якую дададзены лакмус, афарбоўка мяняецца ад фіялетавай да чырвонай — утвараецца сярністая кіслата:
Структурная формула сярністай кіслаты паказана на малюнку 81.

Сярністая кіслата з’яўляецца слабай. Як двухасноўная кіслата яна дысацыіруе ступеньчата:
Гэта таксама азначае, што сярністая кіслата ўтварае два рады солей — сярэднія (сульфіты) і кіслыя (гідрасульфіты).
2. Рэакцыя з растворамі шчолачаў прыводзіць да ўтварэння солей. Састаў прадуктаў залежыць ад мольных суадносін рэагентаў:
2 : 1 або лішак шчолачы |
(сульфіт натрыю) |
1 : 1 або лішак кіслотнага аксіду |
(гідрасульфіт натрыю) |
3. З асноўнымі аксідамі сярністы газ таксама ўтварае солі:
СаО + SO2 = СаSO3.
II. Рэакцыі са змяненнем ступені акіслення.
Рэакцыі з акісляльнікамі. Узаемадзеянне з кіслародам прыводзіць да ўтварэння аксіду серы(VI):
,
што сведчыць аб аднаўленчых уласцівасцях аксіду серы(IV).
Рэакцыя абарачальная, працякае са значнай скорасцю толькі пры павышанай тэмпературы (больш за 440 °С) у прысутнасці каталізатараў (напрыклад, V2O5).
Рэакцыі з адноўнікамі. Прыкладам такой рэакцыі можа служыць утылізацыя сярністага газу вугляродам. Так атрымоўваюць серу з адыходзячых газаў у металургічнай прамысловасці:
Ужыванне аксіду серы(IV). Сярністы газ у прамысловых маштабах з’яўляецца прамежкавым прадуктам пры атрыманні сернай кіслаты. Як харчовая дабаўка (Е220) ён выкарыстоўваецца ў харчовай прамысловасці ў якасці кансерванту. Ім абкурваюць сховішчы гародніны, пладоў і садавіны для абеззаражвання. Яго ўжываюць для адбельвання шоўку і воўны, бо хлор у дадзеным выпадку выкарыстоўваць нельга.
Сярністы газ утвараецца пры спальванні серы і абпале сульфідаў металаў (напрыклад, пірыту, сульфіду цынку).
Аксід серы(IV) у лабараторыі атрымліваюць дзеяннем сернай кіслаты на сульфіты або медзь:
Варта адзначыць, што сярністы газ — адзін з забруджвальнікаў атмасферы. Яго крыніцай з’яўляюцца прадпрыемствы чорнай і каляровай металургіі, цеплаэлектрастанцыі.