§ 34. Кіслародныя злучэнні серы
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 34. Кіслародныя злучэнні серы |
| Напечатано:: | Гость |
| Дата: | Суббота, 16 Август 2025, 05:01 |
Сера, выяўляючы ступені акіслення +4 і +6, утварае два ўстойлівыя аксіды саставу — аксід серы(IV), або сярністы газ, і
— аксід серы(VI).
Аксід серы(IV)
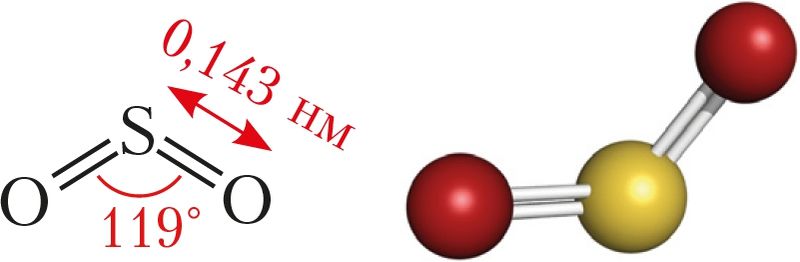
Аксід серы(IV) — рэчыва малекулярнай будовы (мал. 79).
Фізічныя ўласцівасці. Аксід серы(IV) пры нармальных умовах уяўляе сабой бясколерны газ з характэрным рэзкім пахам — пахам запалкі, якая загараецца. Газ таксічны. У адным аб’ёме вады раствараецца каля 40 аб’ёмаў газу пры 20 °С, што значна ніжэй, чым у выпадку хлоравадароду і аміяку. Тэмпература яго кіпення нашмат вышэйшая, чым у кіслароду, і роўная –10 °С. Газ лёгка звадкоўваецца пры пакаёвай тэмпературы ўжо пры невялікім ціску, што дазваляе захоўваць і транспартаваць звадкаваны газ у балонах (мал. 80).

Хімічныя ўласцівасці. У хімічных рэакцыях, якія праходзяць без змены ступені акіслення, аксід серы(IV) павінен праяўляць уласцівасці кіслотнага аксіду: з вадой ён павінен утвараць кіслату, са шчолачамі і асноўнымі аксідамі — солі. Паколькі найніжэйшая ступень акіслення серы роўная –2, а найвышэйшая +6, варта выказаць меркаванне, што для сярністага газу характэрны рэакцыі як з павышэннем ступені акіслення серы, так і з яе паніжэннем.
Пры павышэнні ступені акіслення атамы серы «губляюць» электроны. Гэта азначае, што аксід праяўляе ўласцівасці адноўніку — рэагуе з акісляльнікамі, напрыклад з кіслародам, хлорам. Паніжаючы ступень акіслення, атамы серы далучаюць электроны, а сярністы газ выступае ў ролі акісляльніку. Гэта адбываецца пры ўзаемадзеянні з моцнымі адноўнікам, напрыклад СО, РН3.
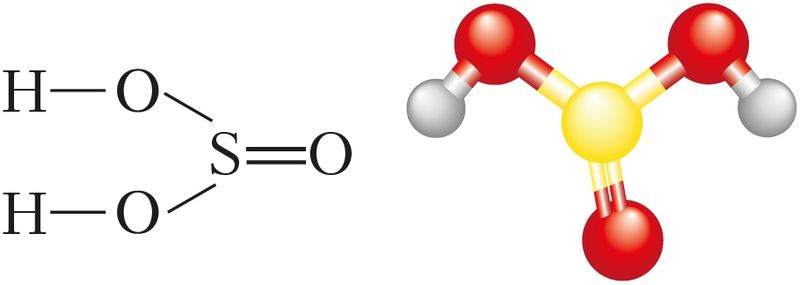
Пракаментуем сказанае і растлумачым ураўненнямі хімічных рэакцый.
I. Рэакцыі без змены ступені акіслення.
1. Рэакцыя з вадой. Пры прапусканні сярністага газу праз ваду, у якую дададзены лакмус, афарбоўка мяняецца ад фіялетавай да чырвонай — утвараецца сярністая кіслата:
Структурная формула сярністай кіслаты паказана на малюнку 81.

Сярністая кіслата з’яўляецца слабай. Як двухасноўная кіслата яна дысацыіруе ступеньчата:
Гэта таксама азначае, што сярністая кіслата ўтварае два рады солей — сярэднія (сульфіты) і кіслыя (гідрасульфіты).
2. Рэакцыя з растворамі шчолачаў прыводзіць да ўтварэння солей. Састаў прадуктаў залежыць ад мольных суадносін рэагентаў:
2 : 1 або лішак шчолачы |
(сульфіт натрыю) |
1 : 1 або лішак кіслотнага аксіду |
(гідрасульфіт натрыю) |
3. З асноўнымі аксідамі сярністы газ таксама ўтварае солі:
СаО + SO2 = СаSO3.
II. Рэакцыі са змяненнем ступені акіслення.
Рэакцыі з акісляльнікамі. Узаемадзеянне з кіслародам прыводзіць да ўтварэння аксіду серы(VI):
,
што сведчыць аб аднаўленчых уласцівасцях аксіду серы(IV).
Рэакцыя абарачальная, працякае са значнай скорасцю толькі пры павышанай тэмпературы (больш за 440 °С) у прысутнасці каталізатараў (напрыклад, V2O5).
Рэакцыі з адноўнікамі. Прыкладам такой рэакцыі можа служыць утылізацыя сярністага газу вугляродам. Так атрымоўваюць серу з адыходзячых газаў у металургічнай прамысловасці:
Ужыванне аксіду серы(IV). Сярністы газ у прамысловых маштабах з’яўляецца прамежкавым прадуктам пры атрыманні сернай кіслаты. Як харчовая дабаўка (Е220) ён выкарыстоўваецца ў харчовай прамысловасці ў якасці кансерванту. Ім абкурваюць сховішчы гародніны, пладоў і садавіны для абеззаражвання. Яго ўжываюць для адбельвання шоўку і воўны, бо хлор у дадзеным выпадку выкарыстоўваць нельга.
Сярністы газ утвараецца пры спальванні серы і абпале сульфідаў металаў (напрыклад, пірыту, сульфіду цынку).
Аксід серы(IV) у лабараторыі атрымліваюць дзеяннем сернай кіслаты на сульфіты або медзь:
Варта адзначыць, што сярністы газ — адзін з забруджвальнікаў атмасферы. Яго крыніцай з’яўляюцца прадпрыемствы чорнай і каляровай металургіі, цеплаэлектрастанцыі.
Аксід серы(VI)
Аксід серы(VI) — найвышэйшы аксід серы (мал. 82).
Аксід серы(VI) утвараецца пры акісленні сярністага газу кіслародам або азонам:

Фізічныя ўласцівасці. Аксід серы(VI) з’яўляецца бясколернай вадкасцю ў вузкім інтэрвале тэмператур: ад 16,9 °С да 44,9 °С. Валодае задушлівым пахам. Пры кантакце са скурай выклікае цяжкія апёкі.
Хімічныя ўласцівасці. — тыповы кіслотны аксід і моцны акісляльнік. Як кіслотны аксід рэагуе з вадой, утвараючы серную кіслату:
У рэакцыях са шчолачамі і асноўнымі аксідамі ўтварае солі:
Асаблівай уласцівасцю аксіду серы(VI) з’яўляецца яго здольнасць растварацца ў сернай кіслаце.
Такі раствор называюць олеум. Ён уяўляе з сябе бясколерную алеістую ліпкую вадкасць, якая дыміцца на паветры, або нават крышталі.
Олеум перавозяць у стальных цыстэрнах. З яго развядзеннем атрымліваюць серную кіслату патрэбнай канцэнтрацыі. Пры гэтым першапачаткова разводзяць сернай кіслатой, бо пры ўліванні олеуму ў ваду адбываецца закіпанне, у выніку чаго ўтвараецца атрутны сернакіслотны туман.
У саставе олеуму, акрамя сернай кіслаты, утрымліваюцца і іншыя кіслоты серы(VI), напрыклад дысерная (або пірасерная):
SO3 + H2SO4 = H2S2O7.
Як акісляльнік SO3 рэагуе з адноўнікам. Атамы серы ў саставе аксіду маюць найвышэйшую ступень акіслення +6 і могуць яе толькі паніжаць, прымаючы электроны ад адноўнікаў. Прыкладам акісляльных уласцівасцей аксіду серы(VI) можа служыць рэакцыя з фосфарам як адноўнікам:
Найважнейшымі кіслароднымі злучэннямі серы з’яўляюцца два кіслотныя аксіды — аксід серы(IV), або сярністы газ SO2, і аксід серы(VI) SO3. Як кіслотныя аксіды яны ўтвараюць кіслоты пры ўзаемадзеянні з вадой і солі ў рэакцыях са шчолачамі і асноўнымі аксідамі.
Аксід серы(IV) праяўляе і акісляльныя, і аднаўленчыя ўласцівасці, а аксід серы(VI)
— толькі акісляльныя.
Пытанні, заданні, задачы
1. Запішыце формулы аксідаў серы і адпаведных ім кіслот, пакажыце іх назвы.
2. Назавіце сферы прымянення сярністага газу.
3. У колбу з дыстыляванай вадой непрацяглы час прапускалі сярністы газ, а потым дадалі некалькі кропель індыкатару. Назавіце афарбоўку змесціва колбы, калі гэтым індыкатарам быў:
- а) лакмус;
- б) метыларанж;
- в) фенолфталеін.
4. Для сярністага газу разлічыце:
- а) шчыльнасць пры н. у. па формуле
;
- б) адносную шчыльнасць па вадародзе;
- в) адносную шчыльнасць па паветры.
5. Запоўніце табліцу «Хімічныя ўласцівасці аксідаў серы» адпаведнымі ўраўненнямі рэакцый для рэагентаў Н2О, KОН, CaO, O2.
| Рэагенты | Аксід серы(IV) | Аксід серы(VI) |
Зрабіце выснову пра падабенства і адрозненне хімічных уласцівасцей названых аксідаў серы.
6. Разлічыце, чаму роўны аб’ём (н. у.) аксіду серы(IV), які прарэагаваў з растворам гідраксіду натрыю, калі пры гэтым утварылася сярэдняя соль масай 37,8 г.
7. Складзіце ўраўненні рэакцый паводле схемы, назавіце кожнае з зыходных рэчываў:
- а)
;
- б)
.
8. Разлічыце мінімальны аб’ём (н. у.) сярністага газу, які трэба прапусціць праз раствор масай 200 г з масавай доляй гідраксіду натрыю 2 %, каб атрымаць толькі кіслую соль.
9. Расстаўце каэфіцыенты метадам электроннага балансу:
- а)
;
- б)
.
Пакажыце, акісляльнікам або адноўнікам з’яўляецца SO2.
10. Разлічыце масавую долю серы ў сумесі, якая змяшчае сульфіт натрыю колькасцю 0,5 моль і гідрасульфіт натрыю колькасцю 0,2 моль.
*Самакантроль
1. З найменшымі стратамі сярністым газам можна напоўніць сасуд:
2. Пры нармальных умовах аксід серы(VI):
- а) не існуе;
- б) газ;
- в) вадкасць;
- г) цвёрдае рэчыва.
3. Адносна абодвух аксідаў серы(IV, VI) слушна, што:
- а) пры растварэнні ў вадзе ўтвараюць кіслоты;
- б) з’яўляюцца прычынай забруджвання атмасферы і выпадзення кіслотных дажджоў;
- в) рэагуючы са шчолачамі, могуць утвараць і кіслыя, і сярэднія солі;
- г) могуць рэагаваць з аксідам барыю.
4. Аксід серы(VI) праяўляе ўласцівасці кіслотнага аксіду, рэагуючы з:
- а) О2;
- б) Na2O;
- в) Са(ОН)2;
- г) СаО.
5. Сума каэфіцыентаў ва ўраўненні рэакцыі cярністага газу з лішкам гідраксіду калію ў поўнай іоннай форме роўная:
- а) 5;
- б) 7;
- в) 8;
- г) 9.