§ 30. Галагены
Хімічныя ўласцівасці

1. Рэакцыі з металамі. Найбольш актыўны з галагенаў фтор. Ужо пры пакаёвай тэмпературы ён рэагуе з большасцю металаў:
Хлор пры награванні рэагуе з серабром, золатам, плацінай і іншымі металамі:
Для дасягнення заўважнай скорасці рэакцыі іншых галагенаў з металамі звычайна таксама патрабуецца папярэдняе награванне металу.
Звернем увагу на тое, што простыя рэчывы хлор і бром з-за высокай акісляльнай здольнасці ўтвараюць з жалезам злучэнні ,
, у той час як дзеянне салянай кіслаты на жалеза прыводзіць да ўтварэння
.
2. Рэакцыі з вадародам:
- а) фтор узаемадзейнічае пры пакаёвай тэмпературы:
;
- б) хлор рэагуе пры падпальванні або ўздзеянні ультрафіялетавага выпраменьвання:
;
- в) бром рэагуе пры награванні:
, реакция обратима;
- г) ёд уступае ў рэакцыю павольна нават пры награванні, рэакцыя абарачальная:
.
Такім чынам, рэакцыйная здольнасць у адносінах да вадароду зніжаецца ў радзе галагенаў F2 — Cl2 — Br2 — I2.
3. Рэакцыі з растворамі солей галагенавадародных кіслот. У водных растворах галагенавадародных кіслот, а таксама іх солей больш электраадмоўны галаген выцясняе менш электраадмоўны. Так, хлор выцясняе бром і ёд, напрыклад:
.
Бром выцясняе толькі ёд з раствораў ёдыду:
.
Здольнасць больш актыўных галагенаў выцясняць менш актыўныя з іх злучэнняў выкарыстоўваецца на практыцы. Напрыклад, бром і ёд атрымліваюць пры дзеянні хлору на іх злучэнні.
Фтору рэакцыя выцяснення з раствораў менш актыўных галагенаў не ўласцівая, бо фтор уступае ў рэакцыю з вадой.
Фтор з вадой рэагуе, акісляючы атамы кіслароду ў малекулах вады:
2F2 + 2H2O = 4HF + O2↑.
Пры растварэнні хлору ў вадзе працякае абарачальная рэакцыя: . Утвораны раствор называюць хлорнай вадой. Аналагічна адбываецца растварэнне ў вадзе брому і ёду, але раўнаважкія канцэнтрацыі прадуктаў памяншаюцца ў радзе Cl2 — Br2 — I2.
4. Рэакцыі з арганічнымі рэчывамі. Галагенаванне арганічных злучэнняў адбываецца часцей за ўсё ў рэакцыях замяшчэння (насычаныя і араматычныя вуглевадароды) або далучэння (ненасычаныя і араматычныя вуглевадароды). Напрыклад:
- • хлараванне метану:
(рэакцыя замяшчэння);
- • брамаванне бензолу:
(рэакцыя замяшчэння);
- • узаемадзеянне бромавай вады з фенолам:
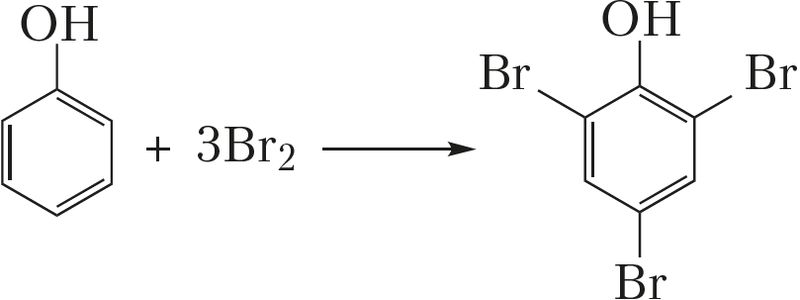 + 3HBr (рэакцыя замяшчэння);
+ 3HBr (рэакцыя замяшчэння);- • хлараванне этылену:
(рэакцыя далучэння).
З курсаў біялогіі і арганічнай хіміі вам таксама вядома, што ёд узаемадзейнічае з растворам крухмалу, утвараючы злучэнне сіняга колеру, а бромавую ваду выкарыстоўваюць як рэагент на алкены, фенол, анілін.
5. Узаемадзеянне хлору са шчолачамі. У залежнасці ад умоў правядзення рэакцыі ўтвараюцца розныя прадукты. Так, пры ўзаемадзеянні з халодным растворам шчолачы хлор утварае солі хларыд і гіпахларыт:
а з гарачым растворам — хларыд і хларат:
Гіпахларыт натрыю шырока ўжываецца для дэзынфекцыі сцёкавых вод, вады ў сістэмах водазабеспячэння і плавальных басейнаў, у харчовай і цэлюлозна-папяровай прамысловасці, медыцыне.
6. Асаблівасці хімічных уласцівасцей фтору. Фтор, у адрозненне ад іншых галагенаў, якія не ўзаемадзейнічаюць з кіслародам, рэагуе з ім, аднак працэс працякае толькі пад дзеяннем электрычнага разраду пры −196 °С:
У гэтым злучэнні атамы фтору маюць ступень акіслення −1, атамы кіслароду як менш электраадмоўнага элемента маюць дадатную ступень акіслення +1. Таму O2F2 называюць фтарыдам кіслароду(I).
Вада пры судакрананні са фторам гарыць. Састаў прадуктаў залежыць ад умоў працякання рэакцыі. Сярод прадуктаў заўсёды выяўляюць фторавадарод і кісларод:
.
У атмасферы фтору акісляецца нават плаціна: . Аднак некаторыя металы (Mg, Al, Ni, Cu) устойлівыя да дзеяння фтору за кошт утварэння шчыльнай плёнкі фтарыду на паверхні металу.
Пад ціскам ці пры дзеянні ўльтрафіялетавага выпраменьвання фтор рэагуе з крыптонам і ксенонам з утварэннем фтарыдаў высакародных газаў.