§ 30. Галагены
| Сайт: | Профильное обучение |
| Курс: | Хімія. 11 клас |
| Книга: | § 30. Галагены |
| Напечатано:: | Гость |
| Дата: | Пятница, 18 Июль 2025, 23:17 |
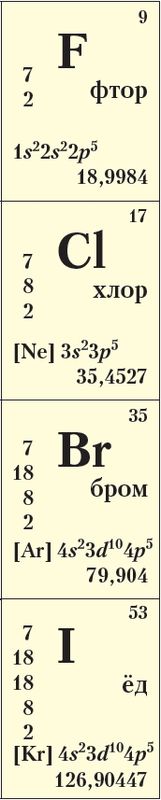
Галагены як хімічныя элементы
Да галагенаў адносяць пяць элементаў VIIА-групы перыядычнай сістэмы: фтор F, хлор Сl, бром Вr, ёд I і астат At.
Атамы галагенаў утрымліваюць па 7 электронаў на знешнім электронным слоі, агульная электронная канфігурацыя якога ns2np5, гэта значыць галагены з’яўляюцца р-элементамі (Дадатак 1). Электроннаграфічныя схемы знешняга электроннага слоя атамаў фтору і хлору выглядаюць наступным чынам:
Пры гэтым на знешнім электронным слоі ў атама фтору чатыры арбіталі, а атамы астатніх галагенаў змяшчаюць яшчэ пяць незапоўненых d-арбіталей.
Фтор як самы электраадмоўны элемент у злучэннях праяўляе толькі адмоўную ступень акіслення –1. Характэрныя для іншых элементаў ступені акіслення (–1, +1, +3, +5, +7) можна растлумачыць магчымасцю распарвання электронаў знешняга электроннага слоя. У выпадку атамаў хлору гэта выглядае так:
Ступені акіслення +1, –1, 0
Ступень акіслення +5
Ступень акіслення +3
Ступень акіслення +7
Прыкладамі злучэнняў з рознымі ступенямі акіслення хлору могуць служыць вядомыя вам рэчывы: (галіт),
(берталетава соль),
(хлорная кіслата).
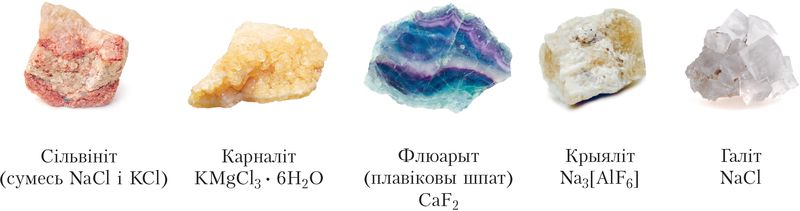
У прыродзе галагены існуюць у выглядзе злучэнняў з іншымі элементамі (табл. 21, мал. 68). Фтор і хлор належаць да дваццаці самых распаўсюджаных элементаў у зямной кары.
Табліца 21. Хімічныя элементы галагены
| Элемент | Радыус атама, нм | χ | Ступені акіслення | Прыродныя злучэнні |
| Фтор 9F | 0,071 | 4,0 | –1, 0 | CaF2 (флюарыт, плавіковы шпат); Na3[AlF6] (крыяліт);); Са5[РО4]3F (фторапатыт)) |
| Хлор 17Cl | 0,099 | 3,0 | –1, 0, +1, +3, +5, +7 | NaCl (каменная соль, галіт); KCl (сільвін);); Смесь NaCl и KCl (сільвініт); KMgCl3 · 6H2O (карналіт) |
| Бром 35Br | 0,114 | 2,8 | –1, 0, +1, +3, +5, +7 | NaBr, KBr, MgBr2 — у адкладах хларыдаў; у марской вадзе ў выглядзе брамід-іонаў |
| Ёд 53I | 0,133 | 2,5 | –1, 0, +1, +3, +5, +7 | KIO3 (ёдат калію) — у адкладах чылійскай салетры, у падземных буравых водах, у марскіх водарасцях |
Галагены як простыя рэчывы
Будова простых рэчываў. Простыя рэчывы галагены складаюцца з двухатамных малекул, атамы ў якіх звязаны кавалентнай непалярнай σ-сувяззю (мал. 69).

У радзе галагенаў F2 — Cl2 — Br2 — I2 з павелічэннем памераў малекул павялічваюцца сілы міжмалекулярнага ўзаемадзеяння, таму ў групе з павелічэннем атамнага нумара элемента павышаюцца тэмпературы плаўлення і кіпення простых рэчываў галагенаў. Так, пры пакаёвай тэмпературы фтор і хлор — газы, бром — вадкасць, ёд — цвёрдае рэчыва (табл. 22).
Табліца 22. Фізічныя ўласцівасці галагенаў
| Рэчыва | Фтор F2 | Хлор Cl2 | Бром Вr2 | Ёд I2 |
| Маштабныя мадэлі малекул | ||||
| Tпл., °С | –220 | ‒101 | ‒7 | +113,5 |
| Tкіп., °С | –188 | ‒34 | +58 | +184 |
| Агрэгатны стан пры пакаёвай тэмпературы | Газ | Газ | Вадкасць | Цвёрдае рэчыва |
| Колер | Светла-жоўты | Жоўта-зялёны | Чырвона-буры | Цёмна-шэры |
| Пах | Рэзкі, раздражняльны | Рэзкі, задушлівы | Рэзкі, смуродны | Рэзкі |
Растваральнасць у вадзе хлору, брому і ёду ўмераная. Іх водныя растворы, якія выкарыстоўваюцца ў лабараторнай практыцы, называюць хлорнай, бромавай і ёднай вадой. Растваральнасць галагенаў значна вышэйшая ў непалярных і малапалярных арганічных растваральніках — бензоле С6Н6, тэтрахлорметане ССl4, этаноле С2Н5ОН.
Хімічныя ўласцівасці

1. Рэакцыі з металамі. Найбольш актыўны з галагенаў фтор. Ужо пры пакаёвай тэмпературы ён рэагуе з большасцю металаў:
Хлор пры награванні рэагуе з серабром, золатам, плацінай і іншымі металамі:
Для дасягнення заўважнай скорасці рэакцыі іншых галагенаў з металамі звычайна таксама патрабуецца папярэдняе награванне металу.
Звернем увагу на тое, што простыя рэчывы хлор і бром з-за высокай акісляльнай здольнасці ўтвараюць з жалезам злучэнні ,
, у той час як дзеянне салянай кіслаты на жалеза прыводзіць да ўтварэння
.
2. Рэакцыі з вадародам:
- а) фтор узаемадзейнічае пры пакаёвай тэмпературы:
;
- б) хлор рэагуе пры падпальванні або ўздзеянні ультрафіялетавага выпраменьвання:
;
- в) бром рэагуе пры награванні:
, реакция обратима;
- г) ёд уступае ў рэакцыю павольна нават пры награванні, рэакцыя абарачальная:
.
Такім чынам, рэакцыйная здольнасць у адносінах да вадароду зніжаецца ў радзе галагенаў F2 — Cl2 — Br2 — I2.
3. Рэакцыі з растворамі солей галагенавадародных кіслот. У водных растворах галагенавадародных кіслот, а таксама іх солей больш электраадмоўны галаген выцясняе менш электраадмоўны. Так, хлор выцясняе бром і ёд, напрыклад:
.
Бром выцясняе толькі ёд з раствораў ёдыду:
.
Здольнасць больш актыўных галагенаў выцясняць менш актыўныя з іх злучэнняў выкарыстоўваецца на практыцы. Напрыклад, бром і ёд атрымліваюць пры дзеянні хлору на іх злучэнні.
Фтору рэакцыя выцяснення з раствораў менш актыўных галагенаў не ўласцівая, бо фтор уступае ў рэакцыю з вадой.
Фтор з вадой рэагуе, акісляючы атамы кіслароду ў малекулах вады:
2F2 + 2H2O = 4HF + O2↑.
Пры растварэнні хлору ў вадзе працякае абарачальная рэакцыя: . Утвораны раствор называюць хлорнай вадой. Аналагічна адбываецца растварэнне ў вадзе брому і ёду, але раўнаважкія канцэнтрацыі прадуктаў памяншаюцца ў радзе Cl2 — Br2 — I2.
4. Рэакцыі з арганічнымі рэчывамі. Галагенаванне арганічных злучэнняў адбываецца часцей за ўсё ў рэакцыях замяшчэння (насычаныя і араматычныя вуглевадароды) або далучэння (ненасычаныя і араматычныя вуглевадароды). Напрыклад:
- • хлараванне метану:
(рэакцыя замяшчэння);
- • брамаванне бензолу:
(рэакцыя замяшчэння);
- • узаемадзеянне бромавай вады з фенолам:
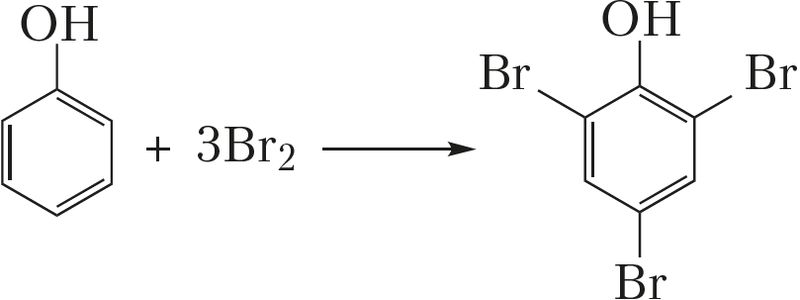 + 3HBr (рэакцыя замяшчэння);
+ 3HBr (рэакцыя замяшчэння);- • хлараванне этылену:
(рэакцыя далучэння).
З курсаў біялогіі і арганічнай хіміі вам таксама вядома, што ёд узаемадзейнічае з растворам крухмалу, утвараючы злучэнне сіняга колеру, а бромавую ваду выкарыстоўваюць як рэагент на алкены, фенол, анілін.
5. Узаемадзеянне хлору са шчолачамі. У залежнасці ад умоў правядзення рэакцыі ўтвараюцца розныя прадукты. Так, пры ўзаемадзеянні з халодным растворам шчолачы хлор утварае солі хларыд і гіпахларыт:
а з гарачым растворам — хларыд і хларат:
Гіпахларыт натрыю шырока ўжываецца для дэзынфекцыі сцёкавых вод, вады ў сістэмах водазабеспячэння і плавальных басейнаў, у харчовай і цэлюлозна-папяровай прамысловасці, медыцыне.
6. Асаблівасці хімічных уласцівасцей фтору. Фтор, у адрозненне ад іншых галагенаў, якія не ўзаемадзейнічаюць з кіслародам, рэагуе з ім, аднак працэс працякае толькі пад дзеяннем электрычнага разраду пры −196 °С:
У гэтым злучэнні атамы фтору маюць ступень акіслення −1, атамы кіслароду як менш электраадмоўнага элемента маюць дадатную ступень акіслення +1. Таму O2F2 называюць фтарыдам кіслароду(I).
Вада пры судакрананні са фторам гарыць. Састаў прадуктаў залежыць ад умоў працякання рэакцыі. Сярод прадуктаў заўсёды выяўляюць фторавадарод і кісларод:
.
У атмасферы фтору акісляецца нават плаціна: . Аднак некаторыя металы (Mg, Al, Ni, Cu) устойлівыя да дзеяння фтору за кошт утварэння шчыльнай плёнкі фтарыду на паверхні металу.
Пад ціскам ці пры дзеянні ўльтрафіялетавага выпраменьвання фтор рэагуе з крыптонам і ксенонам з утварэннем фтарыдаў высакародных газаў.
Біялагічнае значэнне галагенаў і іх злучэнняў
Злучэнні галагенаў выконваюць значную ролю ў жыццядзейнасці арганізмаў чалавека і жывёл.
Фтор удзельнічае ў будове касцявога шкілета і зубной эмалі, у працэсах абмену рэчываў у мышцах, залозах, нервовай тканцы. Пры недастатковым утрыманні фтору ў прадуктах харчавання і пітной вадзе адбываецца пашкоджанне зубной эмалі. Лішак фтору таксама дрэнна ўздзейнічае: прыводзіць да разбурэння зубной эмалі і шкілета.
Хлор уваходзіць у састаў салянай кіслаты як кампанента страўнікавага соку і забяспечвае страваванне ежы, удзельнічае ў абмене рэчываў. Пастаянная канцэнтрацыя кіслаты ў страўніку падтрымліваецца за кошт кухоннай солі, якая паступае ў арганізм з прадуктамі харчавання.
Бром рэгулюе працэсы ўзбуджэння і тармажэння цэнтральнай нервовай сістэмы. Менавіта таму пры лячэнні нервовых хвароб (бяссонніцы, істэрыі, неўрастэніі ды інш.) выкарыстоўваюць бромзмяшчальныя прэпараты.
Ёд адыгрывае значную ролю ў працы шчытападобнай залозы. Найважнейшай функцыяй выпрацаваных у ёй гармонаў з’яўляецца рэгуляцыя працы мозгу і сэрца, мускульнага ўзбуджэння. Недахоп ёду прыводзіць да павелічэння шчытападобнай залозы, запаволення разумовага і фізічнага развіцця.
Вельмі важна з прадуктамі харчавання атрымліваць дастатковую колькасць кожнага мікраэлемента, бо іх недахоп можа стаць пагрозай здароўю.
Фтор, бром, ёд утрымліваюцца ў наступных прадуктах харчавання.
| F | Лісце салаты, шпінат, яблыкі, грэйпфруты, збожжавыя, рыс, бульба, арэхі, цыбуля, чай; прадукты жывёльнага паходжання: марская рыба і морапрадукты, курыца, яйкі, малако, мяса і субпрадукты |
| Br | Бабовыя: фасоля, гарох, сачавіца; арэхі, збожжавыя, марскія водарасці |
| I | Морапрадукты: марская капуста, рыба; малочныя прадукты: малако, сыр, тварог; гародніна: бульба, морква, буракі, цыбуля, памідоры, шпінат, бабовыя; садавіна і ягады: яблыкі, слівы, вінаград, вішні, суніцы; крупы: проса, грэчка |
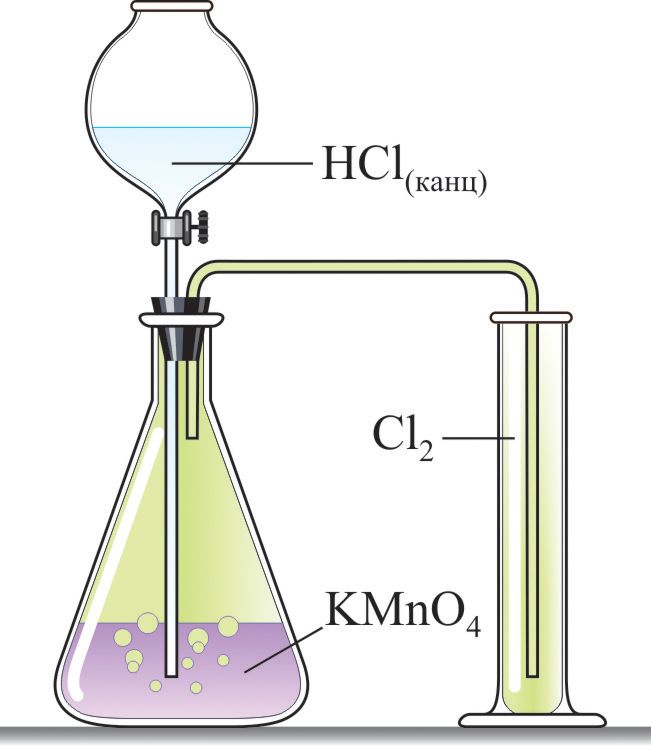
*Атрыманне хлору ў лабараторыі і прамысловасці
Для атрымання хлору ў лабараторыі выкарыстоўваюць рэакцыю канцэнтраванай салянай кіслаты з моцнымі акісляльнікамі (МnO2, KМnO4, KClO3) (мал. 69.1):
;
.
Каб выдаліць следавыя колькасці хлоравадароду, атрыманы газ прапускаюць праз ваду, а для выдалення пароў вады — праз канцэнтраваную серную кіслату.
Упершыню хлор атрымаў шведскі хімік Карл Вільгельм Шэеле (1742–1786) пры ўзаемадзеянні мінералу піралюзіту, г. зн. аксіду марганцу(IV), і салянай кіслаты ў 1774 годзе. Вучонаму належыць гонар адкрыцця мноства неарганічных і арганічных рэчываў.
У прамысловасці хлор атрымліваюць у асноўным электролізам воднага раствору хларыду натрыю. Пры гэтым на анодзе вылучаецца хлор, а на катодзе — вадарод.
Хлор таксама ўтвараецца пры электролізе расплаву хларыду натрыю:
2NaCl(расплаў) 2Na + Cl2↑.
Больш падрабязна працэсы электролізу вы разгледзіце ў раздзеле «Металы».
Для атамаў фтору характэрны ступені акіслення 0, –1; для хлору, брому і ёду: –1, 0, +1, +3, +5, +7.
Галагены з’яўляюцца акісляльнікамі ў рэакцыях з металамі і неметаламі, атамы якіх маюць меншую электраадмоўнасць.
У VIIА-групе акісляльныя ўласцівасці простых рэчываў галагенаў слабеюць пры пераходзе ад фтору да ёду.
Пры галагенаванні арганічных злучэнняў працякаюць, як правіла, рэакцыі замяшчэння або далучэння.
Пытанні, заданні, задачы
1. Укажыце:
- а) сімвалы элементаў галагенаў;
- б) формулы простых рэчываў галагенаў;
- в) біялагічную ролю кожнага з галагенаў;
- г) па тры прадукты харчавання, якія ўтрымліваюць у значнай колькасці фтор, бром, ёд.
2. Для рада рэчываў F2 — Cl2 — Br2 — I2 пакажыце заканамернасць змены:
- а) тэмпературы плаўлення;
- б) тэмпературы кіпення;
- в) актыўнасці ў рэакцыі з вадародам;
- г) актыўнасці ў рэакцыі з металамі. Дайце тлумачэнні.
3. Разлічыце адносную шчыльнасць хлору па паветры.
4. Балон змяшчае 15 кг вадкага хлору. Разлічыце яго колькасць.
5. Складзіце формулы электронных канфігурацый атамаў фтору і хлору. Пакажыце падабенства і адрозненне ў электроннай будове гэтых атамаў.
6. Бром масай 4 г растварылі ў вадзе аб’ёмам 250 см3. Разлічыце масавую долю брому ў бромавай вадзе.
7. Складзіце ўраўненні рэакцый:
- а) хлору з жалезам, натрыем, ёдыдам натрыю, этанам;
- б) брому з жалезам, алюмініем, ёдыдам натрыю, бензолам;
- в) бромавай вады з ёдыдам алюмінію, этыленам, фенолам, анілінам.
8. У балоне змяшчаецца звадкаваны хлор масай 50 кг. Вызначце, які аб’ём зойме хлор пры н. у.
9. Вызначце хімічную формулу солі, у якой масавая доля калію складае 31,836 %, хлору — 28,980 %, кіслароду — 39,184 %. Вызначце ступені акіслення атамаў.
10. У пранумараваных прабірках знаходзяцца растворы фенолу, ёдыду натрыю, хларыду калію. Прапануйце план распазнання рэчываў з дапамогай аднаго рэактыву. Складзіце ўраўненні адпаведных рэакцый.
*Самакантроль
1. Дадатныя ступені акіслення не праяўляюць атамы элемента з канфігурацыяй знешняга электроннага ўзроўню:
- а) 5s25p5;
- б) 4s24p5;
- в) 3s23p5;
- г) 2s22p5.
2. Адносна раду галагенаў F2 — Cl2 — Br2 — I2 справядлівымі з’яўляюцца сцвярджэнні:
- а) павялічваецца даўжыня сувязі ў малекулах простых рэчываў;
- б) хімічная актыўнасць павышаецца;
- в) тэмпература кіпення простых рэчываў узрастае;
- г) узрастае адносная шчыльнасць пароў рэчыва па паветры.
3. Простае рэчыва хлор рэагуе з рэчывамі:
- а) NaBr;
- б) HCl;
- в) КI;
- г) FeCl3.
4. Рэакцыя працякае пры прапусканні праз бромавую ваду газаў:
- а) НCl;
- б) HI;
- в) CН≡СН;
- г) СН3–СН=СН2.
5. Сума каэфіцыентаў ва ўраўненні рэакцыі жалеза з хлорам роўная:
- а) 4;
- б) 5;
- в) 6;
- г) 7.