§ 20. Скорасць хімічных рэакцый
*Самакантроль
1. Хуткасць хімічнай рэакцыі ў СІ вымяраецца:
- а) моль/(дм3 · с);
- б) г/(дм3 · с);
- в) г/с;
- г) моль/с.
2. Паводле графіка вызначце, якая з рэакцый працякае ў пачатковы перыяд часу з большай хуткасцю:
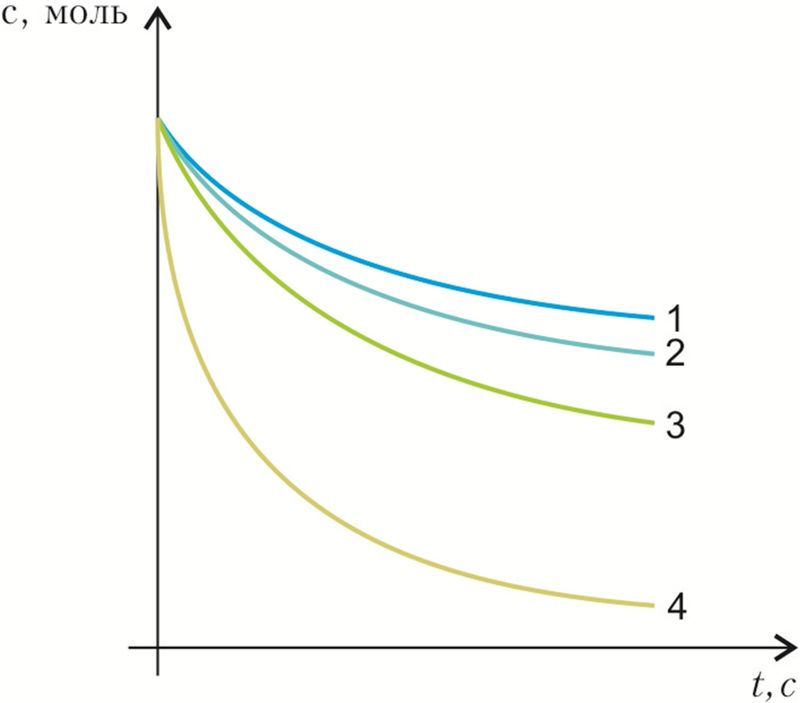
- а) 1;
- б) 2;
- в) 3;
- г) 4.
3. На малюнку паказаны графік змены канцэнтрацыі прадукту неабарачальнай хімічнай рэакцыі ад часу рэакцыі. Штрыхавымі лініямі вылучаны аднолькавыя прамежкі часу: Δt1 = Δt2.
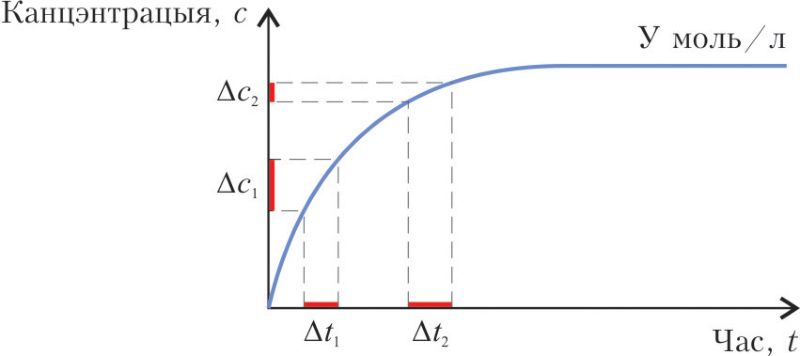
Пры гэтым справядлівымі з’яўляюцца сцвярджэнні:
- а) хуткасць утварэння прадукту ў прамежку часу Δt1 вышэйшая, чым у прамежку Δt2;
- б) змяненне канцэнтрацыі прадукту ў прамежку часу Δt2 вышэйшае, чым у прамежку Δt1;
- в) канцэнтрацыя прадукту праз пэўны час перастае змяняцца;
- г) гарызантальны ўчастак графіка сведчыць пра заканчэнне рэакцыі за кошт поўнага ператварэння зыходных рэчываў у прадукты.
4. Больш нізкай энергіі актывацыі адпавядае:
- а) меншая хуткасць хімічнай рэакцыі;
- б) больш высокая хуткасць рэакцыі;
- в) меншая колькасць вылучанай цеплаты;
- г) большая колькасць вылучанай цеплаты.
5. У аднастадыйнай рэакцыі А + Б = В канцэнтрацыя рэчыва А змянілася ад 2,2 моль/дм3 да 1,6 моль/дм3 за час, роўны 15 с. Сярэдняе значэнне хуткасці расходавання рэчыва Б роўнае моль/(дм3 · с):
- а) 9;
- б) 0,6;
- в) 0,4;
- г) 0,04.