§ 13. Прырода і тыпы хімічнай сувязі
Кавалентная сувязь
Кавалентная сувязь — гэта хімічная сувязь, утвораная агульнымі электроннымі парамі. Яе называюць лакалізаванай, паколькі агульная пара электронаў размяшчаецца (лакалізуецца) паміж двума ядрамі. Гэта прымушае дадатна зараджаныя ядры прыцягвацца да пары электронаў, размешчанай паміж ядрамі. Такая сувязь узнікае паміж атамамі з аднолькавымі або блізкімі значэннямі электраадмоўнасці. Як правіла, гэта атамы неметалаў.
З’яўленне пары электронаў, якая злучае суседнія атамы, можна паказаць двума спосабамі, гэта значыць існуе два механізмы ўтварэння кавалентнай сувязі — абменны і донарна-акцэптарны.
Абменны механізм тлумачыць утварэнне агульнай электроннай пары з няспараных валентных электронаў, якія належаць розным атамам. Пры гэтым электроны, якія ўтвараюць агульную пару, павінны мець супрацьлеглыя (антыпаралельные) спіны. Перакрыванне двух электронных воблакаў прыводзіць да павелічэння электроннай шчыльнасці паміж ядрамі:
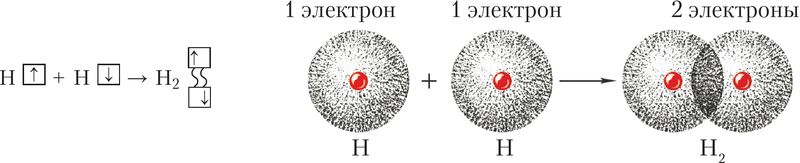
Ва ўтварэнні кавалентнай сувязі могуць удзельнічаць s-, p- і d-электронныя воблакі. Напрыклад, у злучэнні атамаў хлору і вадароду ў малекуле H—Сl удзельнічаюць 1s-электрон атама вадароду і няспараны 3p-электрон атама хлору (мал. 24).
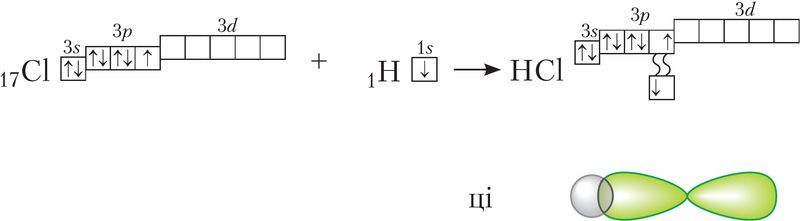
Кожны са звязаных у агульную электронную пару атамаў набывае электронную канфігурацыю высакароднага газу: вадарод — гелію 1s2, а хлор — аргону 1s22s22р63s23р6. У выніку абодва атамы дасягаюць найбольш устойлівай электроннай канфігурацыі.
Яшчэ адзін прыклад — утварэнне сувязей у малекуле аміяку NH3. У атама азоту згодна з электронна-графічнай схемай ёсць тры няспараныя электроны 7N 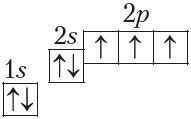 , у атама вадароду — адзін
, у атама вадароду — адзін . Гэтыя электроны ўдзельнічаюць ва ўтварэнні трох кавалентных сувязей па абменным механізме з атамамі вадароду:
![]() или
или ![]()
Адзначым, што адначасова з гэтым у азоту на 2s-арбіталі застаецца непадзеленая электронная пара — пара электронаў, якая не прымае ўдзелу ва ўтварэнні хімічных сувязей.
Абменным механізмам тлумачаць утварэнне кавалентнай сувязі ў пераважнай большасці малекул арганічных і неарганічных рэчываў, у атамных крышталях алмазу C, чырвонага фосфару P, карбарунду SiC, кварцу SiO2 і інш.
Донарна-акцэптарны механізм утварэння кавалентнай сувязі прадугледжвае ўтварэнне электроннай пары за кошт перадачы непадзеленай электроннай пары ад аднаго атама (донара) на вакантную атамную арбіталь другога (акцэптара). У якасці прыкладу разгледзім утварэнне хімічнай сувязі ў катыёна амонію пры працяканні рэакцыі:
(хларыд амонію)
або ў іонным выглядзе:
(іон амонію).
Гэтае ўзаемадзеянне можна паказаць электроннымі формуламі:
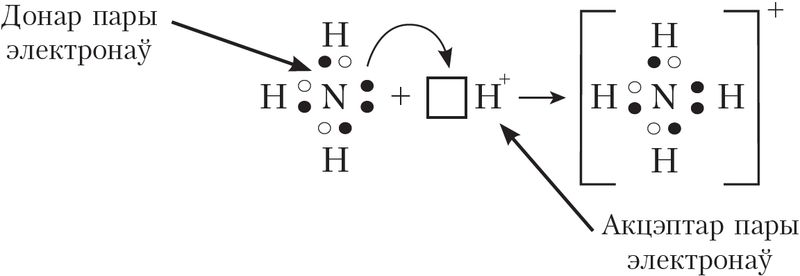
Пры ўзаемадзеянні малекулы 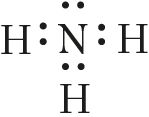 з катыёнам вадароду
з катыёнам вадароду , у якога на 1s-арбіталі няма электронаў, непадзеленая пара электронаў азоту размяшчаецца на свабоднай 1s-арбіталі
іона вадароду. У выніку ўтвараецца катыён амонію
з чатырма кавалентнымі сувязямі:
Паколькі малекула аміяку электранейтральная, а далучаны да яе іон мае зарад «+», то катыён амонію, які ўтварыўся, таксама мае дадатны зарад. Гэты зарад належыць цэламу іону, а не асобнаму атаму, таму ў структурнай формуле знак зараду іона ставяць за квадратнай дужкай: 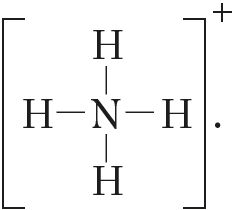 Калі мы хочам падкрэсліць механізм утварэння сувязі, то можна стрэлкай паказаць кірунак зрушвання электроннай пары ад донара да акцэптара:
Калі мы хочам падкрэсліць механізм утварэння сувязі, то можна стрэлкай паказаць кірунак зрушвання электроннай пары ад донара да акцэптара: 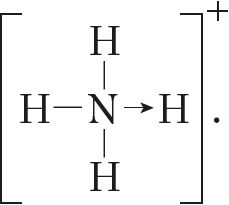 Але рабіць гэта неабавязкова, бо ўсе сувязі ў малекуле, незалежна ад механізму іх утварэння, з’яўляюцца раўнацэннымі.
Але рабіць гэта неабавязкова, бо ўсе сувязі ў малекуле, незалежна ад механізму іх утварэння, з’яўляюцца раўнацэннымі.
Аналагічным чынам можна ўявіць утварэнне хімічнай сувязі ў катыёнаў гідраксонію H3O+: у выніку гідратацыі іона вадароду ў водных растворах непадзеленая электронная пара атама кіслароду ў малекуле вады размяшчаецца на свабоднай 1s-арбіталі іона вадароду.
Донарна-акцэптарным механізмам тлумачаць утварэнне кавалентнай сувязі ў малекулах чаднага газу ![]() , азотнай кіслаты
, азотнай кіслаты 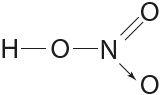 і інш.
і інш.