§ 48.1. Общая характеристика металлов B-групп
Степени окисления атомов d-элементов в соединениях
В отличие от s- и р-элементов у d-элементов в образовании химических связей могут принимать участие не только s-электроны внешнего, но и d-электроны предвнешнего слоёв. Это увеличивает число возможных степеней их окисления. Кроме d-элементов IIIВ- и IIВ-групп, атомы всех остальных d-элементов имеют несколько степеней окисления (табл. 34.1).
С ростом порядкового номера элемента в периоде максимальная (высшая) степень окисления возрастает от IIIВ-группы до первого элемента VIIIВ-группы, а затем убывает. Высшая степень окисления у большинства d-элементов, как правило, отвечает номеру группы, к которой они относятся. Исключение составляют Fe, элементы подгруппы кобальта, никеля и меди (табл. 34.1).
Для атомов элементов IB-группы (Сu, Ag, Аu) возможна не только степень окисления +1 (например, в соединениях Cu2О, AgCl, Au2S), но и более высокая (например, в соединениях ,
).
Соединения элементов, в которых атомы могут находиться в степени окисления +8, известны только для рутения и осмия (например, ). Для остальных элементов VIIIВ-группы характерны более низкие степени окисления.
Максимальная степень окисления для железа равна +6 (например, в соединении K2FeO4). В ней железо является сильным окислителем.
Таблица 34.1. Формулы электронной конфигурации, число валентных электронов и характерные степени окисления* атомов 3d-элементов
| Группа | IIIB | IVB | VB | VIB | VIIB | VIIIB | IB | IIB | ||
| Элементы | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| Степени окисления | +7 | |||||||||
| +6 | +6 | +6 | ||||||||
| +5 | ||||||||||
| +4 | +4 | +4 | ||||||||
| +3 | +3 | +3 | +3 | +3 | +3 | +3 | +3 | |||
| +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | +2 | ||
| +1 | ||||||||||
| Электронная конфигурация валентного слоя | 3d14s2 | 3d24s2 | 3d34s2 | 3d54s1 | 3d54s2 | 3d64s2 | 3d74s2 | 3d84s2 | 3d104s1 | 3d104s2 |
*Наиболее устойчивые степени окисления выделены цветом
Если у элементов А-групп с увеличением порядкового номера по группе устойчивость соединений, в которых атомы элемента проявляет высшую степень окисления, уменьшается, то у элементов В-групп наблюдается обратная закономерность: по группе сверху вниз устойчивость соединений элементов в высшей степени окисления атома, как правило, повышается. Высшие степени окисления в соединениях характерны для золота (+3), платины (+4), осмия (+8), вольфрама (+6).
В низких степенях окисления атомы d-элементов образуют химические связи, близкие к ионному типу, и в растворах существуют в виде катионов, например Mn2+, Fe2+, Ag+:
MnCl2 → Mn2+ + 2Cl–.
В высших степенях окисления для d-элементов характерны анионные формы соединений с ковалентным типом химической связи, например в ионе .
Структурные формулы серной и хромовой кислоты, в которых атомы находятся в одинаковых степенях окисления, однотипны:
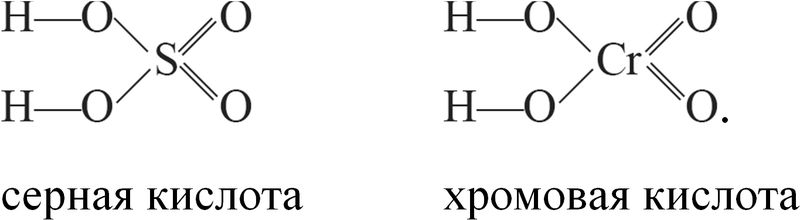
Соединения элементов В-групп в высших степенях окисления проявляют сходство в свойствах с соединениями элементов в тех же степенях окисления А-групп. У них аналогичные формулы оксидов, гидроксидов, кислот и солей. Например, хром, элемент VIB-группы, в степени окисления +6 образует кислотный оксид CrO3 и кислоту H2CrO4, которые по составу и окислительно-восстановительным свойствам аналогичны соединениям серы, элемента VIА-группы, в той же степени окисления +6: SO3 и H2SO4.
Подобное сходство характерно для марганца, элемента VIIB-группы, и хлора, элемента VIIА-группы. В степени окисления +7 марганец образует оксид Mn2O7 (молекулярная жидкость) и соответствующую ему кислоту HMnO4. Хлор в той же степени окисления (+7) образует кислотный оксид Cl2O7 (также молекулярная жидкость) и кислоту HClO4.
Близость свойств этих элементов можно объяснить одинаковым числом неспаренных электронов, которые принимают участие в образовании химических связей с кислородом.
| S | Cr | Cl |
| 6 | 6 | 7 |