§ 28. Общая характеристика неметаллов
Простые вещества
В исторически сложившейся классификации элементов принадлежность к неметаллам определяли по физическим свойствам простых веществ: твёрдое, газообразное или жидкое состояние при нормальных условиях. В твёрдом состоянии у неметаллов, как правило, отсутствует металлический блеск. Их электро- и теплопроводность обычно невелики, вещества являются хрупкими.
Неметаллы образуют два типа кристаллов — молекулярные и атомные (рис. 62).
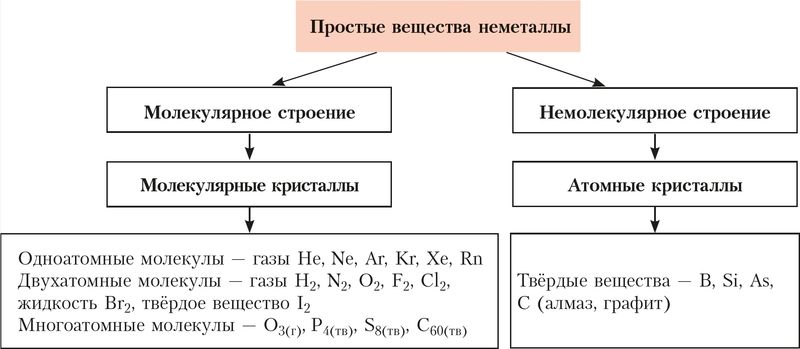
Вещества молекулярного строения отличаются низкими температурами плавления (гелий –272 °С, кислород –223 °С) и кипения (гелий –269 °С, кислород –183 °С). Неметаллы немолекулярного строения, наоборот, имеют чрезвычайно высокие температуры кипения и плавления (графит: Tпл. = 3850 °С, Tкип.= 4200 °С).
Для неметаллов характерно явление аллотропии. Примерами могут служить красный и белый фосфор, алмаз и графит, кислород и озон.
Неметаллы могут вступать в реакции с веществами всех классов (металлами, другими неметаллами, оксидами, щелочами, кислотами, солями) и проявлять как окислительные, так и восстановительные свойства (табл. 20).
Таблица 20. Общие свойства неметаллов как простых веществ
| Неметаллы как окислители вступают в реакции | Неметаллы как восстановители вступают в реакции |
| С металлами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«mi»Mg«/mi»«mn»0«/mn»«/mover»«mover»«mrow»«mo»§#160;«/mo»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«msub»«mover»«mi»Mg«/mi»«mrow»«mo»+«/mo»«mn»2«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mrow»«mo»-«/mo»«mn»4«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mrow»«/mstyle»«/math» |
С некоторыми оксидами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mn»3«/mn»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«msub»«mover»«mi»Fe«/mi»«mrow»«mo»+«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«mrow»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»3«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mrow»«mo»=«/mo»«mo»§#160;«/mo»«/mrow»«mi»t«/mi»«/mover»«mn»3«/mn»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mrow»«mo»+«/mo»«mn»4«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»4«/mn»«mover»«mi mathvariant=¨normal¨»F«/mi»«mn»0«/mn»«/mover»«mi mathvariant=¨normal¨»e«/mi»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»C«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С другими неметаллами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«mover»«mrow»«mn»2«/mn»«mi mathvariant=¨normal¨»P«/mi»«mo»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«mn»3«/mn»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mover»«mo»=«/mo»«mi»t«/mi»«/mover»«mrow»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»P«/mi»«mrow»«mo»+«/mo»«mn»3«/mn»«/mrow»«/mover»«mn»2«/mn»«/msub»«/mrow»«mover»«msub»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mn»3«/mn»«/msub»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mrow»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«/mrow»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»§#8212;«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mrow»«/mstyle»«/math» |
С другими неметаллами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mover»«mrow»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mo mathvariant=¨bold¨ mathcolor=¨#E30613¨»§#160;«/mo»«/mrow»«mn»0«/mn»«/mover»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»=«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mrow»«mo»+«/mo»«mn»4«/mn»«/mrow»«/mover»«msub»«mi mathvariant=¨normal¨»O«/mi»«mn»2«/mn»«/msub»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»S«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С кислотами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mover»«msub»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mn»2«/mn»«/msub»«mn»0«/mn»«/mover»«mo»+«/mo»«msub»«mi mathvariant=¨normal¨»H«/mi»«mn»2«/mn»«/msub»«mover»«mi mathvariant=¨normal¨»S«/mi»«mrow»«mo»-«/mo»«mn»2«/mn»«/mrow»«/mover»«mo»§#160;«/mo»«mo»(«/mo»«mi»§#1088;§#1072;§#1089;§#1090;§#1074;§#1086;§#1088;«/mi»«mo»)«/mo»«mo»=«/mo»«mover»«mi mathvariant=¨normal¨»S«/mi»«mn»0«/mn»«/mover»«mpadded voffset=¨+1px¨»«mo»§#8595;«/mo»«/mpadded»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»H«/mi»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»§#160;«/mo»«mo»(«/mo»«mi»§#1088;§#1072;§#1089;§#1090;§#1074;§#1086;§#1088;«/mi»«mo»)«/mo»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Cl«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
С органическими веществами: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mi»CH«/mi»«mo»§#8801;«/mo»«mi»CH«/mi»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mrow»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mn mathvariant=¨bold¨»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«/mrow»«mover»«mo stretchy=¨false¨»§#8594;«/mo»«mpadded voffset=¨-3px¨»«mi»t«/mi»«mo»,«/mo»«mo»§#160;«/mo»«mi»Ni«/mi»«/mpadded»«/mover»«mo»§#160;«/mo»«mi mathvariant=¨normal¨»C«/mi»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»3«/mn»«/msub»«mo»-«/mo»«mi mathvariant=¨normal¨»C«/mi»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mrow»«mo»+«/mo»«mn»1«/mn»«/mrow»«/mover»«mn»3«/mn»«/msub»«mo»,«/mo»«mspace linebreak=¨newline¨/»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»H«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1074;§#1086;§#1089;§#1089;§#1090;§#1072;§#1085;§#1086;§#1074;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«/mstyle»«/math» |
| С солями: «math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle mathsize=¨14px¨»«mrow»«msub»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mover»«mrow»«mi»KI«/mi»«mo»§#160;«/mo»«/mrow»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»=«/mo»«mo»§#160;«/mo»«msub»«mover»«mi mathvariant=¨normal¨»I«/mi»«mn»0«/mn»«/mover»«mn»2«/mn»«/msub»«mpadded voffset=¨+1px¨»«mo»§#8595;«/mo»«/mpadded»«mo»+«/mo»«mo»§#160;«/mo»«mn»2«/mn»«mi mathvariant=¨normal¨»K«/mi»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mrow»«mo»-«/mo»«mn»1«/mn»«/mrow»«/mover»«mo»,«/mo»«mo»§#160;«/mo»«mover»«mi mathvariant=¨bold¨ mathcolor=¨#E30613¨»Br«/mi»«mn»0«/mn»«/mover»«mo»§#160;«/mo»«mo»-«/mo»«mo»§#160;«/mo»«mi»§#1086;§#1082;§#1080;§#1089;§#1083;§#1080;§#1090;§#1077;§#1083;§#1100;«/mi»«mo»§#160;«/mo»«/mrow»«/mstyle»«/math» |
Окислительные способности атомов неметаллов можно сравнивать по положению в периодической системе: с ростом атомного номера они увеличиваются в периодах и уменьшаются, как правило, в группах. Эти же свойства можно также оценивать, сопоставляя электроотрицательность неметаллов, которая возрастает в ряду:
| Si | B | As | As | H | C | I | S | Br | Cl | N | O | F |
| 1,9 | 2,0 | 2,1 | 2,2 | 2,2 | 2,5 | 2,5 | 2,6 | 2,8 | 3,0 | 3,0 | 3,5 | 4,0 |
Окислительная способность неметаллов с увеличением электроотрицательности усиливается.