§ 27.1. Гидролиз солей
Классификация солей по их подверженности реакции гидролиза
Любая соль может быть представлена как продукт реакции нейтрализации (от лат. neuter — ни тот, ни другой) при взаимодействии кислоты и основания. Кислоты и основания могут быть как сильными, так и слабыми электролитами.
Реакция нейтрализации — это реакция обмена между кислотой и основанием с образованием соли и воды:
KOH + HF = KF + H2O.
Кислоты и основания как электролиты различаются по своей силе. Например, соли аммония можно рассматривать как образованные в реакции с участием слабого основания — гидрата аммиака NH3 · H2O. Соль KF образована сильным основанием KОН и слабой кислотой HF, сульфид аммония — слабым основанием и слабой кислотой.
В зависимости от силы основания и кислоты можно выделить четыре типа солей (рис. 60.1).
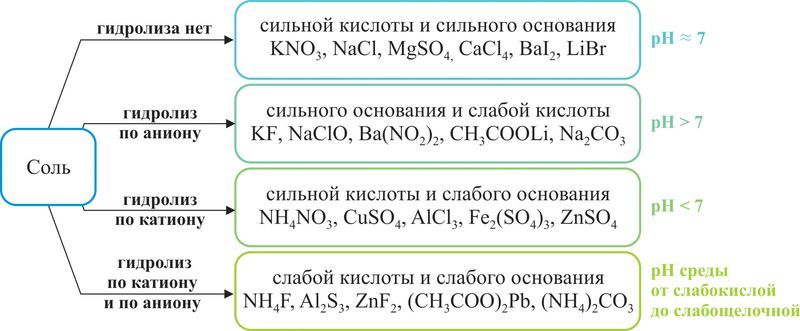
Рассмотрим гидролиз солей всех четырёх типов.
Соли, образованные сильным основанием и слабой кислотой. В качестве примера можно привести ацетат натрия CH3COONa. Эта соль образована сильным основанием NaОН и слабой кислотой CH3COOH:
NaОН + CH3COOH = CH3COONa + H2O.
В водном растворе ацетата натрия происходят два процесса:
а) полная диссоциация сильного электролита — соли CH3COONa на катион и анион:
CH3COONa → Na+ + CH3COO–;
б) взаимодействие ацетат-ионов с молекулами воды с образованием слабого электролита — уксусной кислоты:
CH3COO– + H2О CH3COOH + ОН–.
Избыток анионов ОН– накапливается в растворе и создаёт слабощелочную среду, что свидетельствует о протекании гидролиза по аниону CH3COO–.
Уравнение гидролиза ацетата натрия показывает, что:
- а) в растворе концентрация гидроксид-анионов больше, чем в чистой воде, поэтому раствор СH3COONa имеет слабощелочную среду (pH > 7);
- б) в реакции обмена с водой и в образовании слабой кислоты участвуют только анионы СH3COO–, поэтому говорят, что гидролиз идёт по аниону.
Равновесие гидролиза в данном примере сильно смещено влево — в сторону образования исходных веществ, так как вода — значительно более слабый электролит, чем уксусная кислота СH3COOH.
Гидролиз является реакцией, обратной нейтрализации.
Примеры анионов слабых кислот, соли которых гидролизуются водой:
- а) анионы слабых одноосновных кислот: HCOO–,
, F–;
- б) анионы слабых многоосновных кислот: S2–,
,
,
,
.
Рассмотрим гидролиз карбоната натрия Na2СO3 — соли сильного основания NaOH и слабой двухосновной кислоты H2CO3. Гидролиз протекает по аниону в соответствии с уравнением в полной ионной форме:
2Na+ + + H2O
2Na+ +
+ OH–.
Уравнение в сокращённой ионной форме выглядит так:
+ H2O
+ OH–.
В растворе Na2СO3 образуется избыток гидроксид-анионов и создаётся щелочная среда. Раствор Na2CO3 с концентрацией 0,1 моль/дм3 имеет рН около 11,5.
Соли, образованные сильной кислотой и слабым основанием. Рассмотрим гидролиз хлорида аммония NH4Cl. Это соль сильной кислоты — HCl и слабого основания — гидрата аммиака NH3 · H2O.
В водном растворе соли происходят два процесса:
а) полная диссоциация сильного электролита — соли NH4Cl:
NH4Cl → + Cl–;
б) взаимодействие ионов аммония с молекулами воды с образованием слабого электролита — гидрата аммиака NH3 · H2O:
+ H2O
NH3 · H2O + H+.
Это уравнение показывает, что:
- а) в растворе накапливаются катионы водорода Н+ и их концентрация становится больше, чем в чистой воде, поэтому раствор NH4Cl имеет кислую среду (pH < 7);
- б) в реакции обмена с водой с образованием слабого основания участвуют только катионы аммония
, поэтому говорят, что идёт гидролиз по катиону.
В реакцию с водой могут вступать и многозарядные катионы: двухзарядные Ni2+, Cu2+, Zn2+, Mn2+, Fe2+, Co2+, Pb2+ (кроме катионов Mg2+, Ca2+, Sr2+, Ba2+), трёхзарядные Fe3+, Al3+, Сr3+.
Рассмотрим гидролиз нитрата меди(II) Сu(NO3)2. Это соль сильной кислоты — HNO3 и слабого основания — Cu(OH)2.
В этом случае принято говорить, что гидролиз протекает по катиону Cu2+. Уравнение гидролиза в полной ионной форме:
Cu2+ + + H2O
Cu(OH)+ +
+ H+.
Уравнение гидролиза в сокращённой ионной форме:
Cu2+ + H2O Cu(OH)+ + H+.
Продуктами гидролиза являются основная соль Cu(OH)NO3 и азотная кислота HNO3.
Среда водного раствора нитрата меди(II) кислая (pH ≈ 4,5), поскольку в растворе имеется избыток катионов Н+.
Соли, образованные слабым основанием и слабой кислотой. Такие соли подвергаются гидролизу и по катиону, и по аниону. При этом появляющиеся при гидролизе по катиону ионы Н+ связываются образующимися при гидролизе по аниону ионами ОН–, что усиливает гидролиз. Нередко эта реакция необратима. Например, сульфид алюминия Al2S3 в воде подвергается необратимому гидролизу с образованием нерастворимого гидроксида алюминия и газообразного сероводорода:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑.
Поэтому сульфид алюминия Al2S3 нельзя получить реакцией обмена между водными растворами двух солей, например, нитрата алюминия Al(NO3)3 и сульфида калия K2S.
Возможны и другие случаи необратимого гидролиза. Их нетрудно предсказать, ведь для необратимости процесса необходимо, чтобы хотя бы один из продуктов гидролиза уходил из сферы реакции. Приведём пример совместного необратимого гидролиза катионов Al3+ и анионов :
2Al(NO3)3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaNO3 + 3CO2↑.
Для солей, подвергающихся необратимому гидролизу, в таблице «Растворимость кислот, оснований и солей в воде» вы найдёте примечание: «не существуют в водном растворе».
Подведём итог тому, что вы узнали о гидролизе и по катиону, и по аниону:
- а) если соли гидролизуются по катиону и аниону одновременно, то равновесие в этой реакции больше смещено вправо, чем для гидролиза этих ионов по отдельности;
- б) положение равновесия реакции гидролиза по катиону и аниону не зависит от концентрации соли (докажите это самостоятельно);
- в) реакция среды при этом виде гидролиза может быть нейтральной, слабокислой или слабощелочной, что зависит от силы образующихся основания и кислоты (слабокислая среда свидетельствует о том, что основание является более слабым электролитом, чем кислота, а слабощелочная среда — наоборот);
- г) соли могут необратимо гидролизоваться по катиону и аниону при условии, что хотя бы один из продуктов гидролиза уходит из сферы реакции.
Обобщим информацию о гидролизе различных катионов и анионов в составе средних солей по катионам и анионам в таблице 19.1.
Таблица 19.1. Гидролиз катионов и анионов
| Состав соли | Ионы, по которым не идёт гидролиз | Ионы, по которым идёт гидролиз в порядке усиления | Ионы, по которым идёт сильный гидролиз |
| Катионы | K+, Na+, Li+, Ba2+, Sr2+, Ca2+, Mg2+, Ag+ | Mn2+, Co2+, Zn2+, Ni2+, Fe2+, Pb2+, Cu2+, Be2+ | Al3+, Cr3+, Sn2+, Fe3+ |
| Анионы | Cl–, Br–, I–, |
F–, |
Не гидролизуются: растворимые галогениды (кроме фторидов), нитраты, перхлораты, сульфаты и перманганаты щелочных и щёлочноземельных металлов.
Отметим, что реакции обратимого гидролиза подчиняются принципу Ле Шателье, поэтому гидролиз соли можно как усилить, так и ослабить.