§ 25. Электролитическая диссоциация веществ в растворах
Диссоциация соединений с ковалентным полярным типом связи
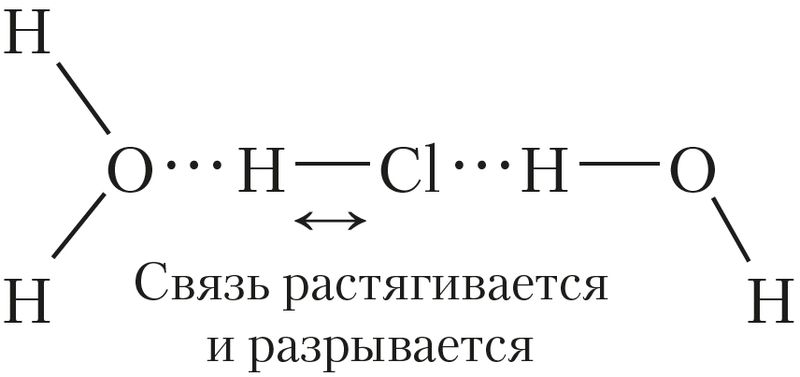
между молекулами H2O и HCl
Большинство органических и неорганических кислот растворимы в воде и являются электролитами. В кислотах атомы водорода связаны ковалентными полярными связями с атомами кислотных остатков. В полярных молекулах готовых ионов нет. Рассмотрим процесс диссоциации кислот на примере молекулы «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mi mathvariant=¨normal¨»H«/mi»«mo»§#8212;«/mo»«mi»Cl«/mi»«/math».
Вначале полярные молекулы кислоты притягиваются к полярным молекулам воды и ещё больше поляризуются.
Образуются водородные связи между молекулами кислоты и воды (рис. 58).
Затем ковалентная полярная связь «math xmlns=¨http://www.w3.org/1998/Math/MathML¨ class=¨wrs_chemistry¨»«mover»«mi mathvariant=¨normal¨»H«/mi»«mrow»«mi mathvariant=¨normal¨»§#948;«/mi»«mo»+«/mo»«/mrow»«/mover»«mo»-«/mo»«mover»«mi»Cl«/mi»«mrow»«mi mathvariant=¨normal¨»§#948;«/mi»«mo»§#8211;«/mo»«/mrow»«/mover»«/math» удлиняется и становится менее прочной. В результате она разрывается, то есть происходит образование ионов:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mi»HCl«/mi»«mo»§#160;«/mo»«mo»§#8594;«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»§#160;«/mo»«mo»+«/mo»«mo»§#160;«/mo»«msup»«mi»Cl«/mi»«mo»§#8211;«/mo»«/msup»«mo».«/mo»«/math»
Получившийся при диссоциации кислоты катион H+ присоединяется к молекуле воды с образованием катиона гидроксония H3O+ по донорно-акцепторному механизму, с которым вы познакомились, изучая материал § 13. Образовавшийся при ионизации ион хлора также оказывается гидратированным, что показано на рисунке 57.
Для упрощения уравнений реакций в ионной форме обычно записывают гидратированный катион водорода в виде Н+.
Аналогичным образом под действием полярных молекул воды происходит диссоциация и других соединений с ковалентным полярным типом связи.
Диссоциация включает процессы гидратации исходных молекул, их поляризации, разрушения связей в молекулах и их распада с образованием гидратированных ионов.
Молекулы кислот при диссоциации в водных растворах полностью или частично диссоциируют на катионы водорода и анионы кислотных остатков:
«math class=¨wrs_chemistry¨ xmlns=¨http://www.w3.org/1998/Math/MathML¨»«mstyle indentalign=¨center¨»«msub»«mi»HNO«/mi»«mn»3«/mn»«/msub»«mo»§#8594;«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»+«/mo»«mo»§#160;«/mo»«msubsup»«mi»NO«/mi»«mn»3«/mn»«mo»-«/mo»«/msubsup»«mo»;«/mo»«mspace linebreak=¨newline¨/»«msub»«mi»CH«/mi»«mn»3«/mn»«/msub»«mi»COOH«/mi»«mo»§#160;«/mo»«mo»§#8644;«/mo»«mo»§#160;«/mo»«msup»«mi mathvariant=¨normal¨»H«/mi»«mo»+«/mo»«/msup»«mo»+«/mo»«mo»§#160;«/mo»«msub»«mi»CH«/mi»«mn»3«/mn»«/msub»«msup»«mi»COO«/mi»«mo»§#8211;«/mo»«/msup»«mo».«/mo»«/mstyle»«/math»