§ 14.1. Гибридизация атомных орбиталей
Самоконтроль
1. Валентный угол определяется:
- а) числом атомных орбиталей данного атома, принимающих участие в образовании σ-связей с другими атомами;
- б) числом σ-связей, образуемых данным атомом;
- в) числом π-связей, образуемых данным атомом;
- г) типом гибридизации атомных орбиталей.
2. В гибридизации атомных орбиталей участвуют:
- а) разные по энергии, но близкие по форме атомные орбитали;
- б) разные по форме, но близкие по энергии атомные орбитали;
- в) 1s-орбиталь и 2p-орбитали;
- г) 2s-орбиталь и 2p-орбитали.
3. Тип гибридизации, представленный схемой, характерен для атомов в молекулах:
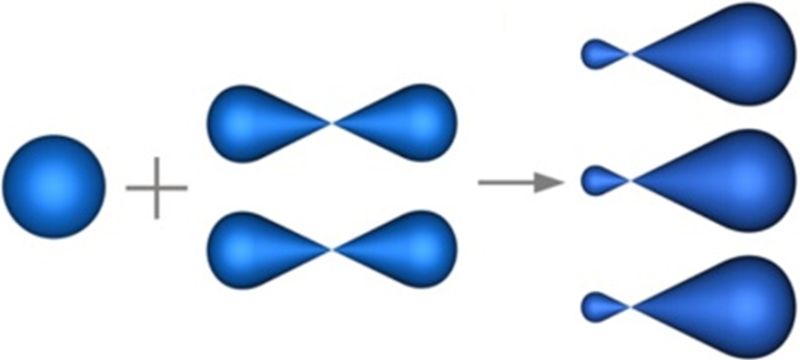
- а) НС≡СН;
- б) Н2С=СН2;
- в) ВF3;
- г) CF4.
4. sp-Гибридные орбитали:
- а) образованы двумя s-орбиталями;
- б) образованы одной s- и одной p-орбиталями;
- в) ориентированы друг к другу под углом 180°;
- г) ориентированы друг к другу под углом 90°.
5. Пространственное строение молекул:
- а) линейное в случае sp-гибридизации;
- б) линейное в случае sp2-гибридизации;
- в) тетраэдрическое в случае sp2-гибридизации;
- г) тетраэдрическое в случае sp3-гибридизации.