§ 13. Природа и типы химической связи
Металлическая связь
Металлическая связь образуется в кристаллах металлов и металлических сплавов за счёт обобществления всеми атомами их валентных электронов.
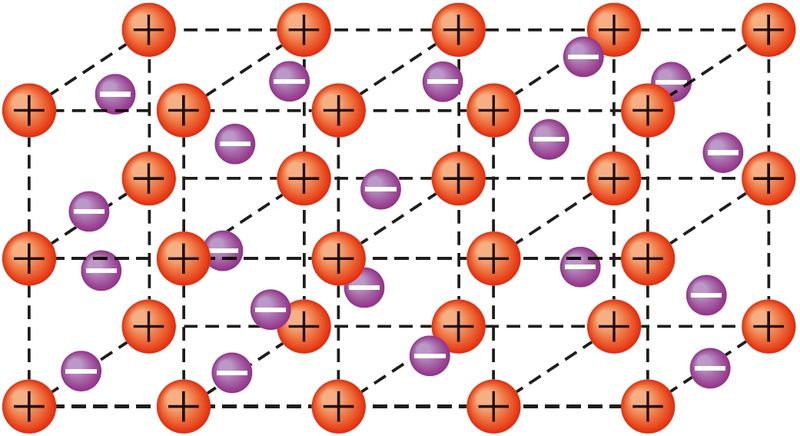
состоящий из регулярно
расположенных катионов металла
и свободно перемещающихся
электронов
Передача атомами металлов своих валентных электронов в коллективное пользование, наличие в металлах свободных электронов — причина электрической проводимости. Образование металлической связи можно описать следующим образом. В атомах металлов на внешнем энергетическом уровне содержится небольшое количество валентных электронов. В любом периоде периодической системы атомы металлов имеют по сравнению с атомами неметаллов больший радиус, меньшее количество валентных электронов и самый малый заряд ядра. Поэтому валентные электроны относительно слабо связаны с ядрами атомов и могут легко перемещаться по всему кристаллу металла. В результате кристалл состоит из положительно заряженных ионов, между которыми перемещаются свободные электроны, так называемый электронный газ (рис. 26).
В таблице 11 суммированы сведения о механизмах образования химических связей и распределении электронной плотности между химически связанными атомами.
Таблица 11. Образование ковалентной, ионной и металлической связей
| Тип связи | Характер обмена электронами между атомами | Условия взаимодействия между атомами |
| Ковалентная связь | Локализация связывающих электронных пар валентных электронов между положительно заряженными ядрами атомов. Возникает преимущественно между атомами неметаллов в молекулах и атомных кристаллах |
 электронных пар |
| Ионная связь | Передача электронов от одного атома другому и образование кристалла из катионов и анионов. Возникает между атомами типичных металлов и неметаллов, в солях, многих оксидах, гидроксидах |
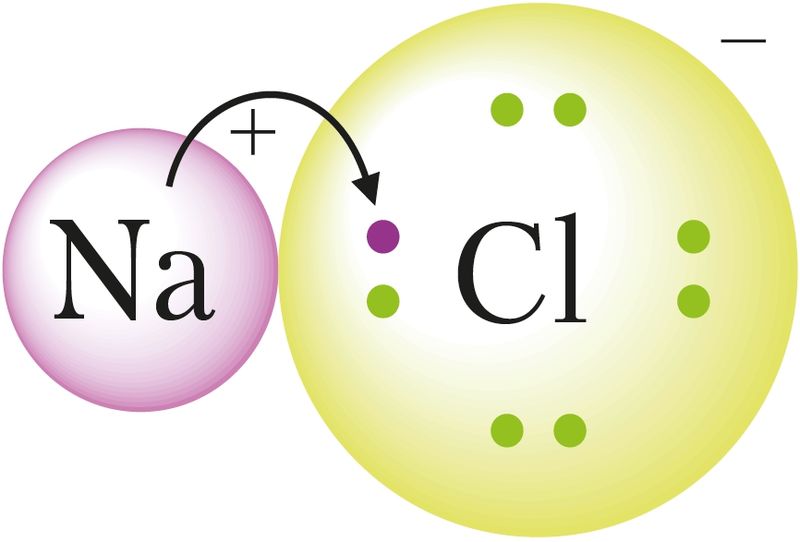 взаимодействие между образовавшимися ионами |
| Металлическая связь | Обобществление валентных электронов и их равномерное распределение в пространстве между всеми атомными ядрами. Возникает в металлах и сплавах |
 валентных электронов |