§ 9. Состояние электрона в атоме
Атомные орбитали, порядок их заполнения электронами
На энергетической диаграмме атомные орбитали изображены в виде клеток (ячеек): (рис. 18). На каждом энергетическом подуровне может находиться только определённое число одинаковых по энергии атомных орбиталей: на любом s-подуровне — одна
, на p — три
, на d — пять
.
Как вам уже известно, на каждой атомной орбитали может разместиться не более двух электронов: , причём электроны должны отличаться своими спинами. Спин условно характеризует вращение электрона вокруг собственной оси по часовой стрелке или против неё. Эти различия у электронов на схеме изображают стрелками, направленными в противоположные стороны. Если на орбитали находится один электрон
, его называют неспаренным, а атомную орбиталь — наполовину заполненной. Если на орбитали два электрона
, то электроны называют спаренными, а орбиталь — заполненной. Атомную орбиталь без электронов называют вакантной, или свободной
.
Вместимость энергетических уровней показана в таблице 5.
Вам известны три способа изображения распределения электронов в атоме:
1) в виде электронных схем (показывают распределение электронов только по энергетическим уровням), например для углерода 6С 2е–, 4е–;
2) в виде формулы электронной конфигурации (показывают распределение электронов по орбиталям), например 6С 1s22s22p2, где цифры перед буквами s и p указывают номер энергетического уровня, буквы s и p — форму электронного облака, а верхний индекс над буквами — число электронов, размещённых на подуровне;
3) с помощью электронно-графических схем (показывают распределение электронов по орбиталям с учётом спина электрона), например:
6C 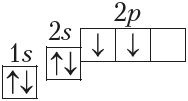
из основного в возбуждённое
состояние
Электронно-графическая схема — это та же энергетическая диаграмма, но с изображением заполнения электронами атомных орбиталей.
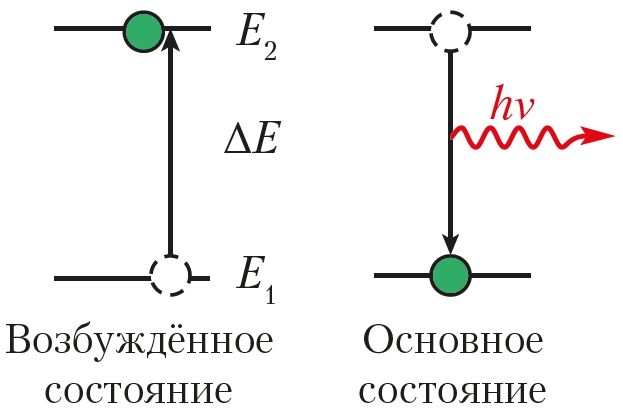
Состояние атома с наименьшей возможной для него энергией электронов называют основным, или невозбуждённым, состоянием. Все другие энергетические состояния этого атома, которым соответствует бо́льшая энергия электронов, чем в основном состоянии, называются возбуждёнными.
Для того чтобы перевести атом в возбуждённое состояние, ему надо сообщить энергию — энергию возбуждения (ΔE) (рис. 19). Она передаётся при воздействии на атом электромагнитного излучения (например, солнечного света), при нагревании или воздействии на атом быстрых электронов. В основном состоянии атом может находиться неограниченно долго, а в возбуждённом — около 10–15 с, после чего возбуждённые электроны возвращаются в основное состояние. Переход атома из возбуждённого состояния в основное сопровождается электромагнитным излучением.