§ 2. Химические соединения в живых организмах. Неорганические вещества
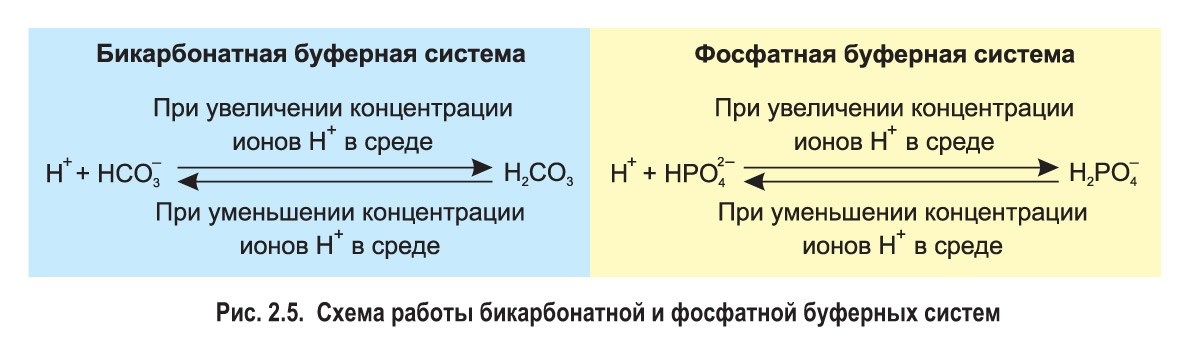
*Буферные системы. Многие биохимические процессы, протекающие в клетках и внеклеточной среде, сопровождаются высвобождением либо, наоборот, связыванием ионов водорода (Н+). Однако живые организмы обладают способностью поддерживать кислотность среды на определенном уровне благодаря существованию так называемых буферных систем.
В поддержании слабощелочной реакции внеклеточной среды участвует бикарбонатная буферная система, образованная угольной кислотой (Н2СО3) и гидрокарбонат-ионом (). Угольная кислота — слабый электролит, поэтому в растворе лишь часть ее молекул диссоциирована и наблюдается равновесие:
.
Если по какой-либо причине концентрация ионов H+ в растворе увеличивается (среда становится более кислой), анионы связывают их:
.
Если кислотность среды снижается, молекулы угольной кислоты диссоциируют, высвобождая дополнительные ионы водорода:
.
Так в растворе сохраняется относительно постоянная концентрация ионов H+. Сходным образом анионы фосфорной кислоты и
, составляющие фосфатную буферную систему, поддерживают нейтральную или слабощелочную среду внутри клеток (рис. 2.5).
Таким образом, буферные системы играют важнейшую роль в обеспечении кислотно-щелочного равновесия организма.*