§ 2. Химические соединения в живых организмах. Неорганические вещества
| Сайт: | Профильное обучение |
| Курс: | Биология. 11 класс |
| Падручнік: | § 2. Химические соединения в живых организмах. Неорганические вещества |
| Надрукаваны: | Госць |
| Дата: |
Friday 3 October 2025 |
В состав живых организмов входят разнообразные химические соединения, образованные атомами различных элементов. Ключевую роль в осуществлении процессов жизнедеятельности играют органические вещества — белки, углеводы, липиды, нуклеиновые кислоты и др., которые в неживой природе практически не встречаются. Однако не все соединения, присущие организмам, специфичны только для живой природы. Такие неорганические вещества, как вода, неорганические (минеральные) соли и кислоты, широко распространены и в неживой природе.
Вода. В количественном отношении первое место среди веществ, входящих в состав живых организмов, занимает вода. Ее массовая доля в организмах в среднем составляет 65—80 %. Количество воды неодинаково в разных тканях и органах. Так, в сочных плодах растений может содержаться до 98 % воды, а в зерновках злаков, семенах подсолнечника, льна, бобовых ее массовая доля составляет 7—14 %. Плазма крови, лимфа, тканевая жидкость, секреты большинства желез животных более чем на 90 % состоят из воды. В скелетных мышцах человека массовая доля воды составляет около 76 %, а в жировой ткани — приблизительно 30 %. С возрастом содержание воды в организме постепенно снижается.
*Организм человека в эмбриональном периоде содержит до 95 % воды. Далее массовая доля воды уменьшается до 80 % (в среднем) у детей, 60—65 % в организме взрослого человека и 45—50 % у пожилых людей. Чем выше содержание воды в клетках и организме в целом, тем интенсивнее протекают процессы обмена веществ.
Человек, потерявший до 50 % массы тела в результате голодания, может остаться в живых, но потеря в результате обезвоживания 20—25 % воды является смертельной. Без употребления воды человек способен прожить не более 3—4 дней.*
 Из курса химии вы знаете, что в молекуле воды (Н2О) два атома водорода соединены с атомом кислорода ковалентными полярными связями. Связи Н—О—Н расположены под углом 104,5° друг к другу. Кислород обладает большей электроотрицательностью, чем водород, поэтому атом кислорода притягивает к себе общие электронные пары и приобретает частичный отрицательный заряд. Атомы водорода приобретают частичный положительный заряд, т. е. молекула воды является полярной (рис. 2.1).
Из курса химии вы знаете, что в молекуле воды (Н2О) два атома водорода соединены с атомом кислорода ковалентными полярными связями. Связи Н—О—Н расположены под углом 104,5° друг к другу. Кислород обладает большей электроотрицательностью, чем водород, поэтому атом кислорода притягивает к себе общие электронные пары и приобретает частичный отрицательный заряд. Атомы водорода приобретают частичный положительный заряд, т. е. молекула воды является полярной (рис. 2.1).
 Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Такое взаимодействие, более слабое, чем ионная связь, называется водородной связью. Каждая молекула воды притягивает к себе за счет образования водородных связей еще четыре молекулы (рис. 2.2).
Между атомом кислорода одной молекулы воды и атомом водорода другой молекулы возникает электростатическое притяжение. Такое взаимодействие, более слабое, чем ионная связь, называется водородной связью. Каждая молекула воды притягивает к себе за счет образования водородных связей еще четыре молекулы (рис. 2.2).
Таким образом, молекулы воды связаны друг с другом. Поэтому вода при температурах от 0 °С до 100 °С может сохранять жидкое агрегатное состояние, тогда как подобные ей водородные соединения (например, H2S, NH3, HF) являются газами.
Роль воды в живых организмах связана с ее свойствами, прежде всего с малыми размерами молекул, их полярностью и способностью образовывать водородные связи между собой и с другими соединениями.
Благодаря полярности молекулы воды способны формировать так называемые гидратные оболочки вокруг ионов и полярных молекул. Это способствует обособлению частиц и препятствует их склеиванию друг с другом, что особенно важно, например, для белковых молекул.
Полярность молекул и способность образовывать водородные связи делает воду универсальным растворителем для полярных веществ, лучшим, чем большинство жидкостей. В зависимости от степени взаимодействия с молекулами воды соединения делят на гидрофильные и гидрофобные. Гидрофильными являются полярные вещества, которые активно взаимодействуют с молекулами воды за счет образования многочисленных водородных связей, что и обусловливает их хорошую растворимость (рис. 2.3, а). К гидрофильным соединениям относятся низшие спирты и карбоновые кислоты, моносахариды, дисахариды и др. Неполярные вещества являются гидрофобными, они не формируют водородные связи с молекулами воды и не растворяются в ней (рис. 2.3, б). Это высшие карбоновые кислоты, жиры и некоторые другие соединения.
Растворение веществ способствует повышению их реакционной способности, т. к. молекулы или ионы получают возможность более свободно перемещаться и взаимодействовать друг с другом. Большинство химических реакций в живых организмах протекает именно в водных растворах. Таким образом, в качестве растворителя вода является основной средой протекания процессов обмена веществ — метаболизма. Кроме того, вода служит средством транспорта растворенных в ней веществ. Эту функцию она выполняет, например, в составе крови, лимфы, тканевой жидкости, мочи и секретов желез животных, в проводящих тканях растений.
Вода является участником многих биохимических процессов, например фотосинтеза. Кислород, выделяющийся в ходе фотосинтеза, образуется при расщеплении молекул воды. Процессы расщепления сложных органических веществ (белков, полисахаридов, липидов и др.) до более простых соединений являются реакциями гидролиза, т. е. протекают при непосредственном участии воды.
Вода практически несжимаема, что важно для поддержания упругости клеток и тканей. Она определяет объем клеток и тургорное давление — давление внутреннего содержимого клетки на ее оболочку. Несжимаемость воды позволяет ей выполнять функцию гидроскелета у круглых и кольчатых червей.
Хорошие смазывающие свойства воды способствуют уменьшению трения в различных частях организма (вспомните роль жидкостей, содержащихся в плевральной полости, околосердечной сумке, полостях суставных сумок человека).
*Каждая молекула жидкости одновременно притягивается ко всем окружающим ее молекулам. При этом силы притяжения, противоположные по направлению, взаимно уравновешивают (компенсируют) друг друга. Поверхностный слой жидкости обладает особыми свойствами, т. к. его молекулы не имеют «соседей» снаружи и притягиваются только друг к другу и к молекулам, находящимся внутри жидкости. Вследствие этого на поверхности образуется так называемая пленка поверхностного натяжения. Из всех жидкостей, кроме ртути, вода обладает самым высоким поверхностным натяжением.
Поверхностное натяжение воды определяет форму клеток, их способность захватывать твердые частицы и капли жидкости. Мелкие организмы, например водомерки, личинки комаров, используют пленку поверхностного натяжения воды для передвижения или прикрепления к ней, а некоторые водные и прибрежные растения — для распространения пыльцы и семян.
Кроме того, поверхностное натяжение воды, а также ее способность взаимодействовать с другими веществами (например, за счет формирования водородных связей) обусловливает свойство капиллярности — способности подниматься или опускаться по узким каналам (капиллярам) и проходить через поры (рис. 2.4). Капиллярность играет важную роль в поднятии растворов по сосудам и трахеидам растений, движении крови, лимфы и других жидкостей по системе мелких сосудов в организме животных.*
Вода обладает высокой теплоемкостью. Это значит, что при поглощении или выделении большого количества теплоты температура самой воды изменяется незначительно. Поэтому даже резкие температурные колебания в окружающей среде не приводят к существенному изменению температуры внутри организма.
При переходе жидкой воды в состояние пара происходит разрушение всех водородных связей между ее молекулами, а это требует значительных затрат энергии. Поэтому испарение воды сопровождается охлаждением и используется живыми организмами для защиты от перегрева (потоотделение у млекопитающих, транспирация у растений).
Вода имеет относительно высокую для жидкостей теплопроводность. Движение воды (циркуляция крови у животных, восходящий и нисходящий ток растворов у растений и т. д.) в сочетании с высокой теплопроводностью способствует равномерному распределению теплоты в организме.
Важнейшие биологические функции воды представлены в таблице 2.1.
Таблица 2.1. Основные функции воды в живых организмах
|
Функция |
Пояснение |
|
Структурная |
Входит в состав всех клеток, межклеточного вещества, внутренней среды организма, секретов желез и т. д., придает упругость клеткам и тканям, у некоторых животных выполняет функцию гидроскелета |
|
Метаболическая |
Является средой протекания и участником биохимических реакций |
|
Транспортная |
Способствует всасыванию растворенных веществ, их перемещению в организме и выведению конечных продуктов обмена веществ |
|
Терморегуляторная |
Участвует в регуляции теплового режима организмов |
Неорганические (минеральные) соли и кислоты, как и вода, входят в состав всех живых организмов. Их общее содержание в организмах сравнительно невелико и обычно не превышает 1—1,5 %, однако эти вещества выполняют важные биологические функции.
Нерастворимые соли принимают участие в построении различных опорных структур живых организмов, обеспечивая их прочность. Например, карбонат кальция (CaCO3) является важным компонентом раковин моллюсков, панцирей ракообразных, скорлупы яиц, скелетов коралловых полипов и др. Фосфаты кальция составляют основу межклеточного вещества костной ткани позвоночных животных. Твердость зубной эмали обусловлена наличием минеральных солей, в состав которых входит кальций, магний, фосфор и фтор. Скелет некоторых протистов образован сульфатом стронция (SrSО4).
Растворимые соли при взаимодействии с водой диссоциируют, поэтому в живых организмах они содержатся в виде ионов. Содержание определенных катионов и анионов внутри клеток, как правило, значительно отличается от их концентрации во внеклеточной среде. Так, в клетках наблюдается достаточно высокая концентрация катионов калия (K+) и низкая — натрия (Na+), а во внеклеточной среде — наоборот. Причем содержание К+ в клетках и Na+ за их пределами неодинаково. Это приводит к возникновению разности электрических потенциалов между внутренней и наружной сторонами цитоплазматической мембраны, что необходимо для возбуждения клеток, генерации и передачи нервных импульсов.
Запомнить особенность распределения ионов калия и натрия поможет следующая фраза: «Калий идет в Клетку, а НАтрий — НАружу».
Некоторые ионы входят в состав ферментов, витаминов и других биологически активных веществ. Например, ион Co+ — структурный элемент витамина В12, Mg2+ — хлорофилла, Fe2+ входит в состав гемоглобина и т. д. Катионы Са2+ и Mg2+ влияют на активность ряда ферментов и, следовательно, играют важную роль в регуляции обмена веществ.
Ионы и
являются источниками атомов азота, ион
— атомов серы, которые необходимы автотрофным организмам для синтеза аминокислот. *Кроме того, сульфат-ионы важны для обезвреживания токсичных веществ в организме человека и животных. Присоединяясь к молекулам этих веществ, ионы
повышают их растворимость в воде, способствуя тем самым выведению из организма.*
Неорганические кислоты также играют важную биологическую роль. Например, соляная кислота (HCl), входящая в состав желудочного сока позвоночных животных, создает в желудке кислую среду. Это способствует уничтожению болезнетворных микроорганизмов и активации ферментов желудочного сока. Остатки фосфорной кислоты входят в состав фосфолипидов, нуклеотидов, АТФ. Фосфорная и угольная кислоты, а также анионы этих кислот участвуют в поддержании определенной кислотности внутри клеток и во внеклеточной среде.
Кислотность среды. Возможность протекания биохимических реакций, их скорость и результат во многом зависят от кислотности среды, т. е. от концентрации ионов водорода (H+). Количественно эту величину выражают при помощи водородного показателя рН (пэ-аш).
В водных растворах величина рН обычно принимает значения от 0 до 14. Нейтральная среда характеризуется значением рН = 7, в щелочной среде рН больше 7, в кислой — меньше 7. Чем больше величина рН отличается от 7, тем более кислым или щелочным является раствор.
В цитоплазме клеток, как правило, поддерживается нейтральная или слабощелочная среда (pH = 7,0—7,4). Вне клеток среда обычно слабощелочная. Например, в плазме крови человека величина pH в норме составляет 7,36—7,44. Однако в разных частях организма, в различных биологических жидкостях этот показатель может сильно варьировать.
В желудке человека реакция среды кислая, а в кишечнике — щелочная. У здоровых людей при нормальном питьевом режиме и сбалансированном питании pH мочи составляет 5—6, но при тяжелой физической работе или употреблении большого количества мясной пищи этот показатель снижается. Молочно-растительная диета, наоборот, приводит к тому, что реакция мочи становится щелочной. *Более подробная информация о величинах рН в организме человека содержится в таблице 2.2.*
*Таблица 2.2. Значения pH некоторых биологических жидкостей организма человека
|
Желудочный сок |
1,0—2,0 |
|
Секрет на поверхности кожи (смесь пота, кожного сала и др.) |
3,5—6,7 |
|
Моча |
4,5—8,0 |
|
Слюна |
7,0—7,8 |
|
Сок тонкого кишечника |
7,2—7,5 |
|
Слезная жидкость |
7,3—7,5 |
|
Спинномозговая жидкость (ликвор) |
7,35—7,8 |
|
Плазма крови |
7,36—7,44 |
|
Сок поджелудочной железы |
7,5—9,0 |
|
Желчь |
8,0—8,5 |
|
Содержимое толстого кишечника |
8,5—9,0* |
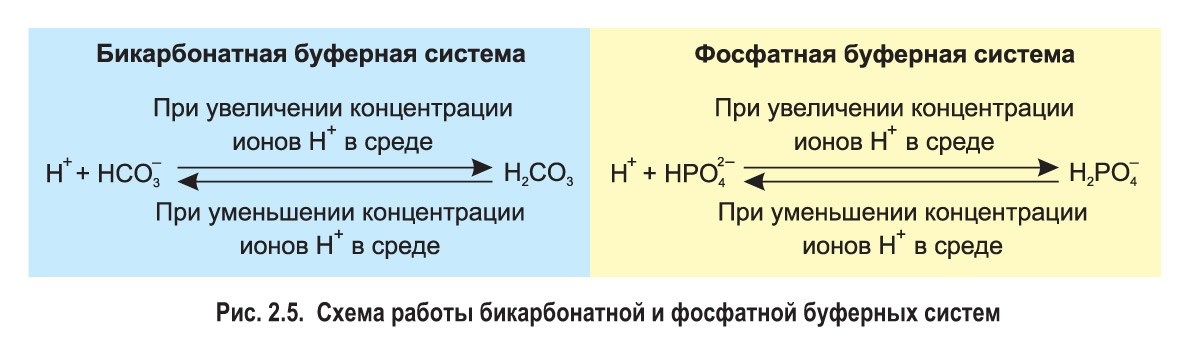
*Буферные системы. Многие биохимические процессы, протекающие в клетках и внеклеточной среде, сопровождаются высвобождением либо, наоборот, связыванием ионов водорода (Н+). Однако живые организмы обладают способностью поддерживать кислотность среды на определенном уровне благодаря существованию так называемых буферных систем.
В поддержании слабощелочной реакции внеклеточной среды участвует бикарбонатная буферная система, образованная угольной кислотой (Н2СО3) и гидрокарбонат-ионом (). Угольная кислота — слабый электролит, поэтому в растворе лишь часть ее молекул диссоциирована и наблюдается равновесие:
.
Если по какой-либо причине концентрация ионов H+ в растворе увеличивается (среда становится более кислой), анионы связывают их:
.
Если кислотность среды снижается, молекулы угольной кислоты диссоциируют, высвобождая дополнительные ионы водорода:
.
Так в растворе сохраняется относительно постоянная концентрация ионов H+. Сходным образом анионы фосфорной кислоты и
, составляющие фосфатную буферную систему, поддерживают нейтральную или слабощелочную среду внутри клеток (рис. 2.5).
Таким образом, буферные системы играют важнейшую роль в обеспечении кислотно-щелочного равновесия организма.*

Среди неорганических веществ в составе живых организмов важнейшая роль принадлежит воде. Ее основными биологическими функциями являются структурная, метаболическая, транспортная и терморегуляторная. Минеральные соли и кислоты также играют важную роль в процессах жизнедеятельности организмов. На протекание биохимических реакций влияет концентрация ионов Н+ — кислотность среды, поддержание которой обеспечивается буферными системами.
 |
1. Какие неорганические вещества входят в состав живых организмов? 2. Какие вещества называют гидрофильными? Гидрофобными? Приведите примеры. 3. Охарактеризуйте биологическую роль минеральных солей и кислот. 4. Сколько воды содержится в живых организмах и от чего это зависит? Почему растения при недостатке воды увядают? 5. Как вы думаете, почему большинство полярных веществ хорошо растворяются в воде, а неполярные, как правило, в ней нерастворимы? 6. Какие функции выполняет вода в живых организмах? 7. Какую биологическую функцию выполняют буферные системы? Охарактеризуйте механизм работы бикарбонатной и фосфатной буферных систем. 8*. Как физические и химические свойства воды связаны с ее биологическими функциями? 9*. Как вы думаете, почему азотная и соляная кислоты, а также их анионы, не обладают буферными свойствами? |

Самодельный pH-индикатор
Чтобы определить кислотность среды, не обязательно использовать индикаторы из химической лаборатории. Вы можете сделать свой собственный рН-индикатор.
Хорошим природным индикатором является, например, сок краснокочанной капусты. Его естественная сине-фиолетовая окраска (в нейтральной среде) меняется в зависимости от рН следующим образом:
|
рН |
2 |
4 |
6 |
8 |
10 |
12 |
|
Цвет |
красный |
пурпурный |
фиолетовый |
синий |
сине-зеленый |
зеленый |
Измельчите листья краснокочанной капусты и отцедите сок. С его помощью можно определить величину водородного показателя различных растворов.
Подобными свойствами также обладает сок некоторых других растений, например свеклы, вишни, черники, винограда темных сортов, черной смородины, граната, ежевики (при использовании этих соков возможно проявление других цветовых оттенков). Если пропитать полученным соком бумагу (лучше всего — фильтровальную), получатся удобные для использования индикаторные бумажки.
Попробуйте с помощью полученного индикатора определить рН:
– молока;
– чая;
– уксуса;
– нашатырного спирта;
– соков (яблочного, лимонного, апельсинового и др.);
– минеральных вод;
– газированных напитков;
– растворов соды, мыла, стирального порошка и т. д.
● Какие вещества, содержащиеся в соке краснокочанной капусты и других растений, являются природными рН-индикаторами? Для ответа воспользуйтесь дополнительной литературой или интернет-ресурсами.
● Какими свойствами обладают эти вещества?
● Какие исследованные вами пищевые продукты имеют рН, близкий к физиологическим значениям внутриклеточной и внеклеточной среды организма?
● Чтобы улучшить цвет борща, в него добавляют немного уксуса или лимонного сока. На чем основан этот способ?